La microbiota intestinal influye mucho más allá del aparato digestivo. En un nuevo estudio publicado en Circulation Research (abril de 2025), investigadores de Cedars-Sinai Medical Center han demostrado que desequilibrios en las bacterias intestinales pueden contribuir directamente a la inflamación cardiovascular.
Utilizando un modelo murino que imita las características de la enfermedad de Kawasaki, observaron que modificar la composición bacteriana del intestino puede agravar o aliviar significativamente las lesiones en vasos coronarios.
Eliminar ciertas bacterias intestinales disminuyó la gravedad de la vasculitis en el corazón y la aorta. El trabajo identifica especies clave que promueven o protegen contra esta inflamación y propone nuevas estrategias terapéuticas basadas en bacterias beneficiosas, ácidos grasos de cadena corta (SCFAs) y proteínas bacterianas que fortalecen la barrera intestinal.
Estos hallazgos abren un nuevo campo para comprender y tratar trastornos vasculares inflamatorios desde el eje intestino-corazón.
Las bacterias intestinales agravan o protegen contra la inflamación vascular
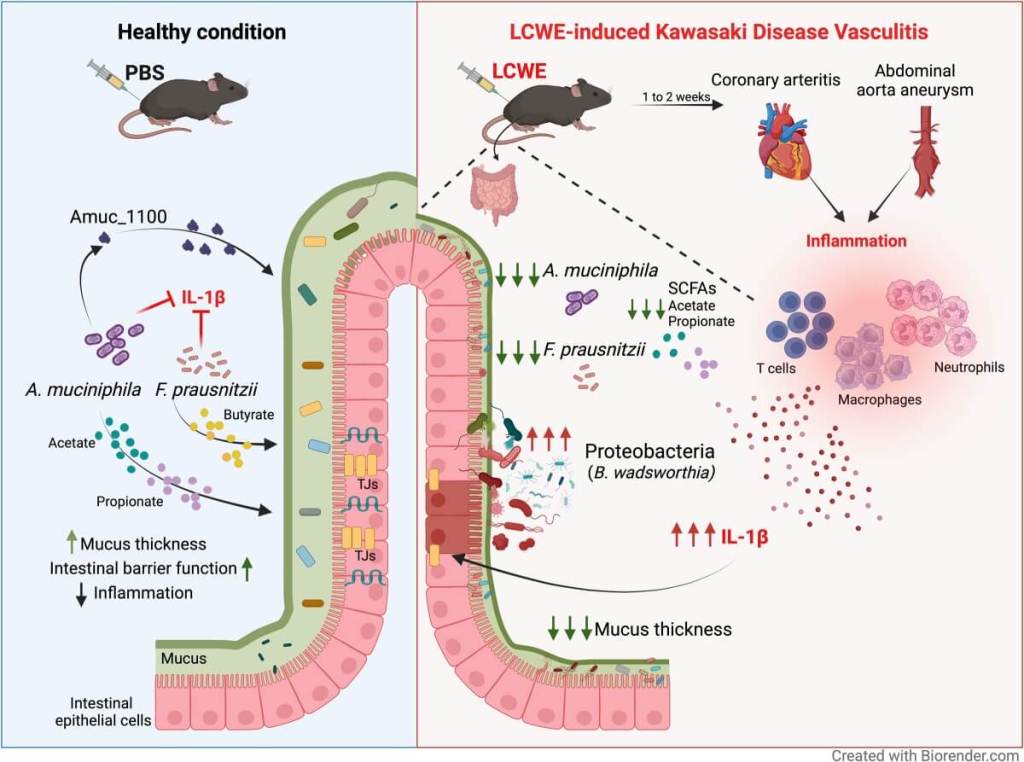
Los investigadores emplearon un modelo murino inducido con extracto de pared celular de Lactobacillus casei, que reproduce las lesiones observadas en la enfermedad de Kawasaki.
En condiciones normales, estos ratones desarrollaron inflamación en las arterias coronarias, aortitis y dilataciones en la aorta abdominal. Sin embargo, al tratar a los animales con antibióticos para eliminar su microbiota intestinal, la severidad de la vasculitis disminuyó notablemente.
La ausencia de microbiota intestinal protegió a los ratones de desarrollar inflamación cardiovascular severa. Este efecto se replicó en ratones completamente libres de bacterias (germ-free), así como en crías de madres tratadas con antibióticos.
Incluso una microbiota reducida como la de la flora Schaedler alterada fue suficiente para reducir la inflamación. Estos resultados muestran que la microbiota no solo está relacionada, sino que es funcionalmente necesaria para que se desarrolle la inflamación vascular.
Posteriormente, mediante análisis de secuenciación del gen 16S rRNA, se identificaron cambios significativos en la composición de las bacterias intestinales en los ratones con vasculitis.
Las especies proinflamatorias Bilophila wadsworthia y Bacteroides fragilis estaban aumentadas, mientras que las especies antiinflamatorias Akkermansia muciniphila y Faecalibacterium prausnitzii disminuyeron. Este desequilibrio fue exclusivo de los animales con lesiones cardiovasculares.
Dos especies bacterianas agravan la vasculitis experimental
Para demostrar la función directa de las bacterias patobiontes, los investigadores suplementaron a ratones tratados con antibióticos con una mezcla de B. fragilis y B. wadsworthia.
Estos animales mostraron más inflamación en corazón y aorta, con un mayor infiltrado de linfocitos T, neutrófilos y macrófagos activados. Además, presentaban niveles elevados de lipopolisacáridos circulantes, un marcador de permeabilidad intestinal alterada.
Estas bacterias favorecen la inflamación vascular al debilitar la barrera intestinal. Los ratones con mayor colonización mostraron peor evolución cardiovascular. Por el contrario, los que no alcanzaron altos niveles de estas especies no desarrollaron daño severo.
Esto confirma que su proliferación en el intestino no solo es un marcador, sino una causa probable de la inflamación sistémica.
Este mecanismo parece depender de la capacidad de estas bacterias para alterar la barrera intestinal. Cuando esta se debilita, las toxinas bacterianas pueden alcanzar la circulación y activar la respuesta inmunitaria en tejidos distantes como el corazón.
El resultado es una cascada inflamatoria que afecta a los vasos medianos y grandes.
Bacterias beneficiosas que previenen el daño cardiovascular
En contraste, los investigadores evaluaron el efecto de suplementar a los ratones con bacterias conocidas por sus propiedades antiinflamatorias: F. prausnitzii y A. muciniphila. Al administrarlas por vía oral, ya fuera vivas o pasteurizadas, lograron disminuir la inflamación en corazón y aorta, así como los niveles de IL-1β, una citocina clave en la enfermedad de Kawasaki.
Estas bacterias redujeron la infiltración inmunitaria y restauraron la integridad de la mucosa intestinal. También aumentaron la cantidad de células caliciformes y la expresión de uniones estrechas en el intestino, lo cual refuerza la barrera epitelial.
Estos efectos se mantuvieron incluso cuando el tratamiento comenzó después de la inducción de la enfermedad, lo que sugiere una utilidad terapéutica.
Otro hallazgo relevante es que el efecto protector fue similar al administrar las bacterias pasteurizadas, lo que facilita su posible aplicación clínica. Este resultado indica que los beneficios no dependen exclusivamente de su actividad metabólica, sino también de sus componentes estructurales estables al calor.
Uno de los principales productos generados por estas bacterias beneficiosas son los ácidos grasos de cadena corta (SCFAs), como el acetato, propionato y butirato. En el modelo de vasculitis, los niveles fecales de estos compuestos estaban disminuidos.
Al suplementarlos en el agua, los animales presentaron menos inflamación vascular, menor infiltrado inmune y mejores marcadores de integridad intestinal.
Los SCFAs refuerzan la barrera intestinal y modulan la producción de IL-1β. Su administración aumentó la expresión de genes de uniones estrechas, redujo la permeabilidad intestinal y la presencia de lipopolisacáridos en sangre. En cultivos celulares, inhibieron la síntesis de IL-1β en macrófagos activados con LCWE, mostrando un efecto inmunomodulador directo.
Este efecto también se observó cuando los SCFAs se administraron tras la inducción de la enfermedad, aunque su eficacia disminuyó al retrasar el inicio del tratamiento. Los resultados refuerzan la importancia de mantener un ecosistema intestinal productor de SCFAs para prevenir procesos inflamatorios sistémicos.
Una proteína bacteriana con efecto terapéutico
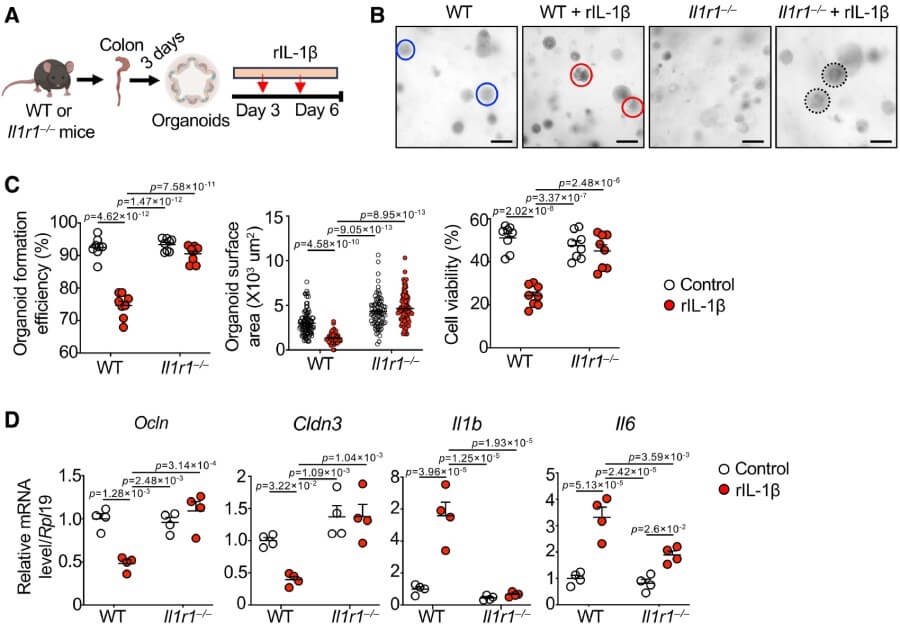
La pasteurización de A. muciniphila preserva una de sus proteínas clave: Amuc_1100. Esta molécula de membrana externa se une al receptor TLR-2 y mejora la función de la barrera intestinal.
En este estudio, su administración redujo la inflamación vascular, restauró la expresión de uniones estrechas y disminuyó la producción de IL-1β e IL-6 en organoides intestinales estimulados con esta citocina.
Amuc_1100 redujo el daño vascular y protegió la mucosa intestinal en ratones con vasculitis. Su efecto fue comparable al de la bacteria completa pasteurizada, lo que sugiere que puede ser una alternativa más estable y segura para futuras terapias. Además, se trata de una proteína que puede purificarse y administrarse de forma controlada.
Este hallazgo allana el camino para el desarrollo de tratamientos dirigidos que imiten los efectos protectores de la microbiota saludable. La posibilidad de actuar sobre la barrera intestinal con moléculas definidas representa una estrategia terapéutica prometedora para enfermedades inflamatorias sistémicas.
Relevancia clínica y futuras estrategias preventivas
La enfermedad de Kawasaki es la principal causa de cardiopatía adquirida en niños. Aunque el tratamiento con inmunoglobulina intravenosa es eficaz en la mayoría de los casos, hasta un 20% de los pacientes no responden bien y presentan mayor riesgo de aneurismas coronarios. Los hallazgos de este estudio ofrecen nuevas alternativas para mejorar el abordaje terapéutico.
Modular la microbiota o administrar sus productos puede convertirse en una estrategia preventiva complementaria. Este enfoque no reemplaza el tratamiento inmunitario convencional, pero podría reforzarlo y disminuir la resistencia a las terapias actuales. Además, el uso de compuestos pasteurizados o proteínas aisladas facilita su aplicación clínica.
Aunque estos resultados provienen de un modelo experimental en ratones, representan un avance clave para entender el papel del intestino en enfermedades cardiovasculares inflamatorias. Estudios futuros en pacientes permitirán determinar si estas intervenciones pueden aplicarse de forma segura y eficaz en la práctica pediátrica.
Referencias
- Jena, Prasant K., et al. Intestinal Microbiota Contributes to the Development of Cardiovascular Inflammation and Vasculitis in Mice. Circulation Research. (2025). doi: 10.1161/CIRCRESAHA.124.325079
Cortesía de Muy Interesante
Dejanos un comentario: