Los átomos de los elementos químicos de la tabla periódica son las piezas fundamentales de la química. Estos se agrupan en moléculas tan simples como el oxígeno que respiramos, compuesto de solo dos átomos, o el ADN que nos define, compuesto de miles. Átomos y moléculas tienen un tamaño tan sumamente pequeño que las leyes de la mecánica clásica no pueden explicar su comportamiento en experimentos cuidadosamente planificados y es necesario recurrir a leyes de la teoría cuántica, leyes que han tenido y tienen un enorme impacto en la ciencia y la tecnología. Baste decir, por ejemplo, que sientan la base de toda electrónica. Para entender su impacto en la química describimos de manera cronológica sus hitos más relevantes, que nos conducirán a una perspectiva cuántica de la misma.
Este viaje temporal comienza con la figura de Ernest Rutherford (premio Nobel de Química, 1908) y sus experimentos que mostraron, por primera vez, la existencia de átomos compuestos de cargas eléctricas positivas y negativas moviéndose en un espacio prácticamente vacío. Para entender el resultado de sus experimentos, Rutherford sugirió un modelo atómico similar a nuestro sistema solar. El Sol sería el pesado núcleo atómico formado por protones (cargas positivas), mientras que los planetas serían los ligeros electrones (cargas negativas) que orbitaban alrededor del núcleo. Inicialmente, Rutherford no consideró la complicada estructura del núcleo atómico, materia de la que se ocupa la física nuclear. En el modelo de Rutherford, los electrones se mueven a gran velocidad alrededor del núcleo siguiendo órbitas circulares. Sin embargo, el mismo Rutherford fue consciente de la debilidad de su modelo, ya que las ecuaciones de Maxwell de la electrodinámica clásica predecían, sin duda alguna, que una carga acelerada pierde energía en forma de radiación electromagnética, por lo que los electrones deberían perder energía, indefectiblemente precipitándose al núcleo, un fenómeno que no sucede.
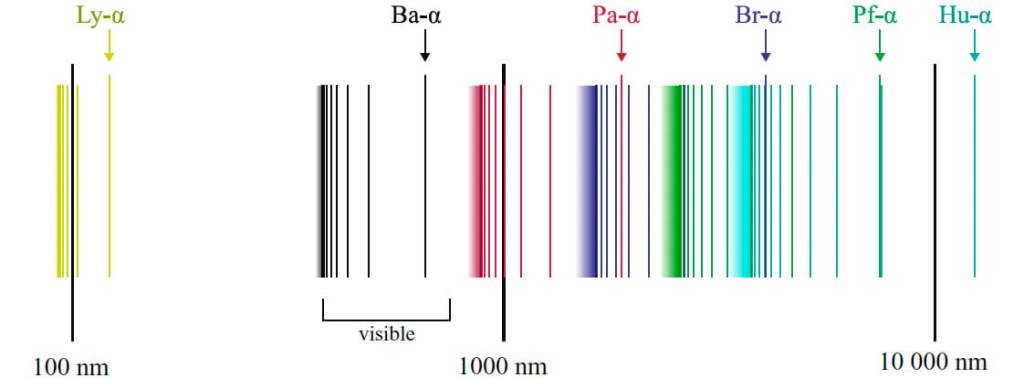
Basándose en la hipótesis de Max Planck (premio Nobel de Física 1918), que establecía que los cambios de energía en sistemas muy pequeños no son continuos, sino a saltos (los llamados cuantos, múltiplos de la constante de Planck), Niels Henrik David Bohr (premio Nobel de Física en 1922) sugirió que, puesto que los átomos son estables, los electrones orbitaban alrededor del núcleo, pero solo en ciertas órbitas permitidas, y que el cambio de una órbita a otra implicaba un cambio de energía en cuantos; como si los planetas del sistema solar pudieran intercambiar sus órbitas planetarias al absorber o emitir ciertas cantidades de energía. Bohr aplicó su modelo al átomo más simple, el de hidrógeno, compuesto de un solo protón y electrón, pudiendo explicar de manera cuantitativa el llamado espectro del hidrógeno, el conjunto de líneas que se obtienen al irradiar una muestra de hidrógeno atómico con luz y observar la luz emitida después.
La contribución de Bohr no finalizó con su modelo atómico. Junto a Werner Heisenberg (premio Nobel de Física en 1932), Erwin Schrödinger (premio Nobel de Física en 1933), y una larga lista de otros científicos premiados, contribuyó a la conocida interpretación de Copenhague que explica, rigurosa y cuantitativamente, el comportamiento de átomos y moléculas. En esta nueva teoría cuántica, plenamente vigente, existen ideas que chocan con el sentido común. Por ejemplo, afirma que es imposible conocer (medir) con exactitud algunas propiedades como son la posición y el momento de un electrón y también que un objeto cuántico puede no tener un estado definido hasta que se mide, lo cual implica que el acto de medir afecta al sistema, lo que a su vez abre cuestiones filosóficas como: ¿Qué es medir?, o ¿hace falta un ser inteligente para medir? Una paradoja famosa es la del gato de Schrödinger. Sin embargo, Born y Heisenberg sostenían que la mecánica cuántica solo describe la naturaleza tal y como se observa, no cómo funciona realmente.
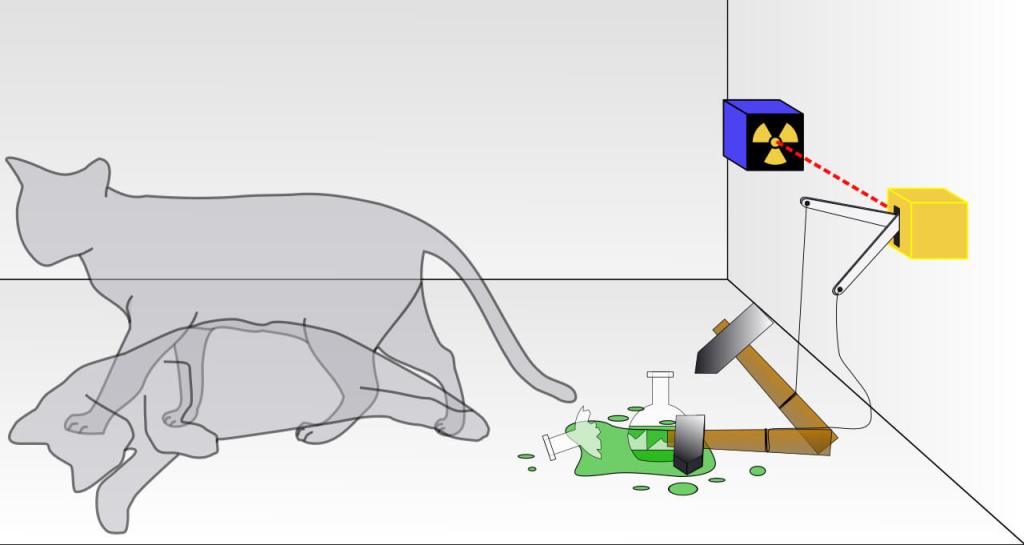
Gato de Schrödinger
Uno de los experimentos mentales más famosos es el gato de Schrödinger, que ayuda a interiorizar la idea de la superposición de estados. Una versión adaptada podría ser la siguiente: imaginemos que hay un gato encerrado en una caja donde también hay un frasco con una sustancia radioactiva, con un 50 % de probabilidad de desintegrarse en media hora. Si lo hace, el frasco, que contiene una sustancia mortal, se rompe. Al estar la caja cerrada, al cabo de media hora no sabemos si la desintegración se ha producido y, por tanto, si el gato está vivo o muerto. No lo hemos comprobado, o medido. Es en el preciso momento de la apertura de la caja cuando observamos al gato y su posible estado colapsa a un estado definido (vivo o muerto). Pero hasta que esto ocurra, según la interpretación de Copenhague, el gato está en un estado de superposición de vivo y muerto a la vez. Pero que el lector no se escandalice ante dicha analogía, a todas luces escabrosa a día de hoy. Milton, el gato de Schrödinger en Oxford, no sufrió ningún percance ni su vida estuvo en peligro.
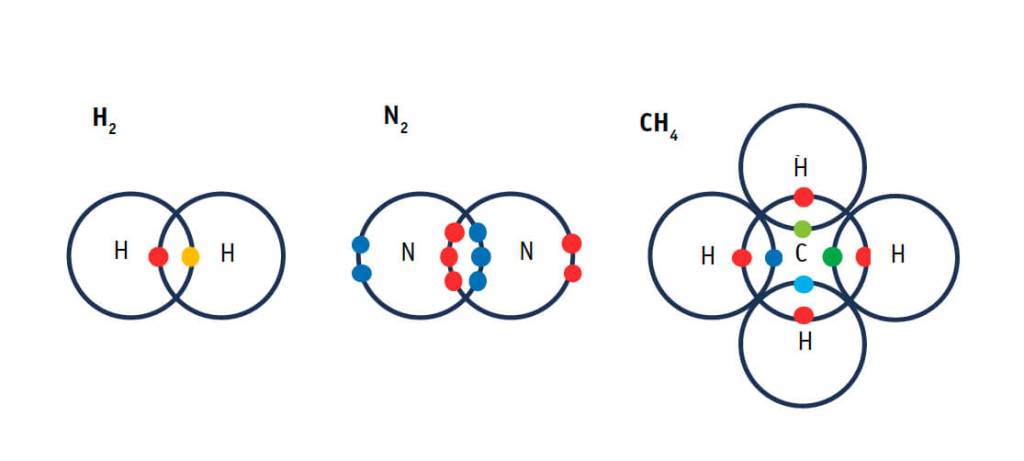
Aparte de muchos otros logros, la mecánica cuántica describe elegantemente la interacción entre varios átomos; en otras palabras, el enlace químico. ¿Por qué se forma un enlace químico entre átomos de un mismo elemento o entre átomos con electronegatividad —tendencia a atraer electrones— parecida? El primer modelo que explica el enlace químico es el de Lewis (1916), que propone que los átomos pueden compartir electrones de manera que puedan completar los que les corresponde para llegar a completar una capa atómica, dos en el caso del hidrógeno, pero ocho en átomos del primer periodo de la tabla periódica. Los electrones se distribuyen en pares, de enlace o libres. Sirva como ejemplo la ilustración de las moléculas de H2 , N2 y CH4 mostrada en la figura de abajo.
El modelo cualitativo de Lewis permite entender el enlace químico a grandes rasgos, pero presenta excepciones y no hace predicciones cuantitativas acerca de su magnitud o de la geometría espacial de los átomos en las moléculas. Para llegar a una descripción cuantitativa es menester resolver la ecuación de Schrödinger,
propia de cada sistema y que tiene en cuenta la energía cinética de núcleos y electrones, así como las interacciones atractivas o repulsivas entre ellos debido a sus cargas. Las matemáticas de la mecánica cuántica demuestran que la ecuación de Schrödinger siempre tiene solución, la llamada función de onda, que contiene toda la información sobre las propiedades del sistema cuántico objeto de estudio.
El gran desafío: hallar soluciones aproximadas
Si bien se puede afirmar de manera rigurosa que la ecuación de Schrödinger tiene solución, encontrarla supone un desafío enorme y solo es posible determinar soluciones suficientemente aproximadas como para explicar cuantitativamente la estructura, estabilidad y reactividad química de las moléculas. El objetivo de la química cuántica es precisamente desarrollar métodos que permitan encontrar estas soluciones aproximadas, ardua tarea en la que el desarrollo de los modernos ordenadores y superordenadores ha sido decisivo. De todas maneras, la ecuación de Schrödinger resulta demasiado complicada incluso para ordenadores con miles de procesadores trabajando en paralelo. En este punto cabe destacar la contribución de Born y Oppenheimer, quienes argumentaron que, debido a que los núcleos son al menos 1800 veces más pesados que los electrones, se puede resolver la ecuación de Schrödinger en dos etapas. En la primera, se considera que los núcleos están quietos, y se obtiene la energía (aproximada) de los electrones, y se demuestra que esta define el potencial en el que se mueven los núcleos, mientras que en la segunda se resuelve el movimiento de los núcleos. Este proceso a dos tiempos permite determinar la estructura de las moléculas en el espacio. Sin embargo, el potencial en el que se mueven los núcleos de una molécula de N átomos implica, en general, 3N-6 dimensiones, y no se puede visualizar. En ocasiones se puede representar secciones bidimensionales de esta superficie que indican puntos donde la energía es mínima, correspondientes a especies estables, y con caminos definidos de mínima energía que conectan dichos mínimos. Es como un mapa topográfico de montaña que indica el camino más fácil para pasar de un valle a otro, como en la imagen que se muestra arriba.
La aplicación de la mecánica cuántica a la química dio lugar a la disciplina que se conoce como química cuántica, la cual permite una interpretación cuantitativa del enlace químico. Las primeras aplicaciones permitían obtener tan solo resultados muy aproximados como los obtenidos por Walter Heitler y Fritz London, cuyo modelo es el embrión de la teoría del enlace de valencia desarrollada posteriormente por Linus Pauling (premio Nobel de Química 1954) y más tarde por Friedrich Hund, que desarrolló las primeras ideas de lo que se conoce como teoría de los orbitales moleculares, posteriormente sistematizados por Rober Mulliken (premio Nobel de Química 1966). En el límite ambas teorías coinciden, y, en el fondo, ambas consideran a la función de onda exacta de n electrones como una función expresable como una combinación de otras funciones que describen los electrones en orbitales atómicos, combinables para representar orbitales moleculares.
Para el estado de energía más bajo, o más estable, existe una forma particular de disponer los electrones en los orbitales moleculares que domina el sistema.
La química cuántica ha permitido desarrollar algoritmos para predecir las propiedades atómicas y moleculares
Usando estas ideas, Hückel utilizó un método aproximado combinando de manera lineal orbitales atómicos que permitió entender la aromaticidad del benceno. El desarrollo de la tecnología computacional fue clave para que los diferentes métodos de cálculos comenzaran a asentarse como una nueva disciplina; la química computacional, no en vano en la conferencia de aceptación del premio Nobel de Química, Mulliken afirmó que veía el día en que cada vez más químicos usarían la computación en lugar de ir al laboratorio para obtener información relevante de la estructura y reactividad de las moléculas. En este camino, un punto crucial fue la publicación de los teoremas de Hohenberg y Kohn en 1964, en los que se demuestra que la energía exacta del estado más estable de un sistema químico depende solo de la densidad electrónica del estado fundamental, una función tan solo tres coordenadas espaciales, en vez de 3n como la función de onda de un sistema de n electrones. La densidad electrónica se puede obtener de la función de onda, pero obviamente, esto no supone ninguna ventaja. El segundo de los teoremas indica que, de todas las densidades posibles, la que da la energía más baja (no se sabe exactamente cómo hacerlo) es también la densidad exacta y la energía es la exacta. Esto abrió las puertas a intentar obtener la energía a partir de una densidad aproximada y constituye lo que se denomina teoría del funcional de la densidad —density functional theory o DFT de sus siglas en inglés—.
La consolidación de la química cuántica y computacional
Todo este desarrollo de la química cuántica junto al desarrollo tecnológico de los ordenadores ha permitido a químicos, físicos y matemáticos desarrollar algoritmos y programas con el fin de predecir las propiedades atómicas, moleculares y encontrar caminos que llevan a las reacciones químicas. Estos avances fueron una vez más reconocidos con el premio Nobel de Química de 1998 a Walter Kohn y John Pople por el desarrollo del DFT y por el desarrollo de métodos computacionales en química cuántica, respectivamente. Hoy en día, los estudios computacionales ayudan a encontrar el punto de inicio de una síntesis de laboratorio o ayudar a racionalizar resultados experimentales. La consolidación de la química cuántica y computacional permite encontrar y diseñar nuevas entidades químicas, identificar correlaciones entre estructura química y propiedades generando entidades químicas de valor añadido y contribuye de manera importante al diseño moléculas con funcionalidades específicas en la industria farmacéutica.
Antes de finalizar y volviendo al principio de superposición, recuerde el lector el gato de Schrödinger, la mecánica cuántica abre las puertas a una computación diferente a la tradicional. La computación cuántica permitirá realizar multitud de operaciones simultáneamente a una velocidad que superará los límites actuales permitiendo el estudio de sistemas químicos más complejos.
Cortesía de Muy Interesante
Dejanos un comentario: