Puede que el corte haya cerrado y el tejido esté intacto, pero el cuerpo no lo olvida. Investigadores de la Universidad de Toronto-Mississauga han demostrado que una lesión física puede transformar de forma duradera la manera en que el sistema nervioso reacciona ante el estrés. Usando un modelo en ratones, observaron que una antigua herida puede “preparar” al cerebro y al cuerpo para una respuesta exagerada de miedo y dolor frente a una amenaza futura, incluso si no existe un nuevo daño.
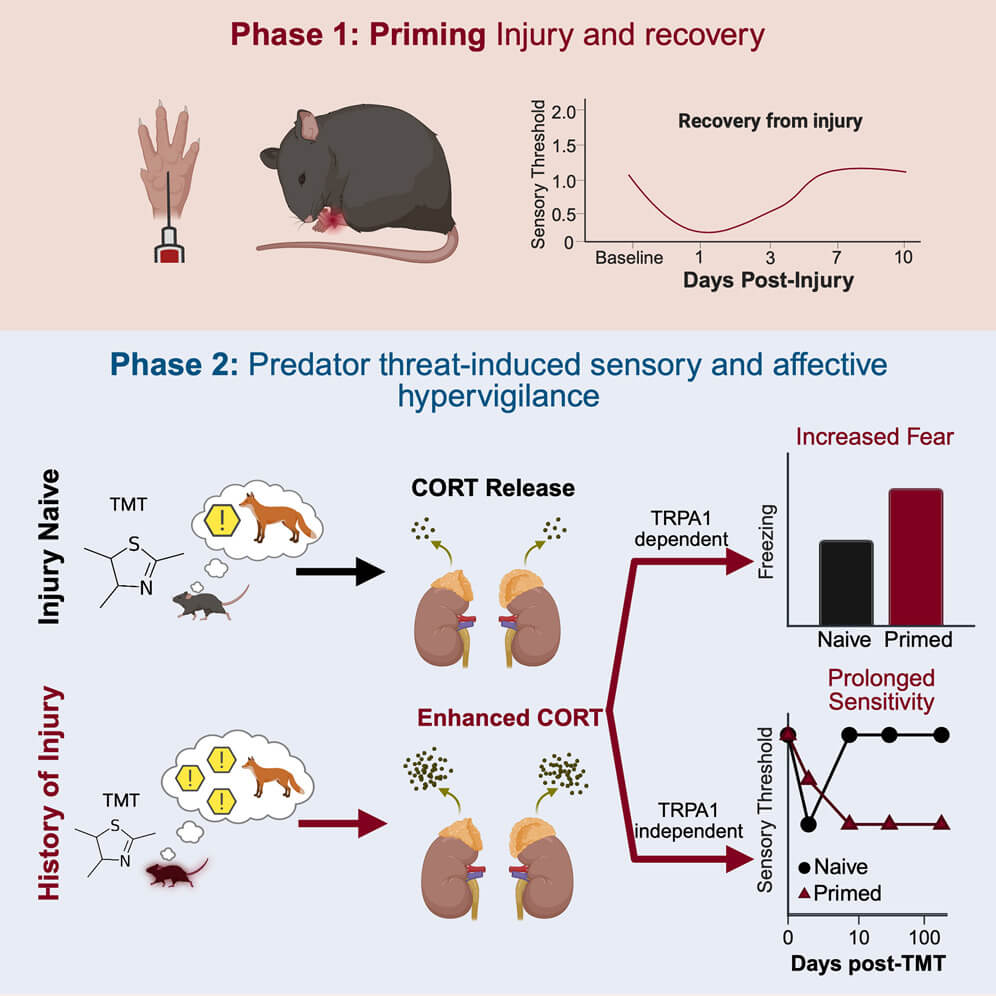
Las lesiones pasadas pueden hacer que el sistema nervioso entre en un estado de hipersensibilidad permanente. En el experimento, los ratones fueron expuestos al olor de un depredador meses después de haber sufrido una lesión menor. A pesar de que el daño físico ya estaba curado, los animales respondieron con un temor intenso y una reactivación del dolor, no solo en la zona herida, sino también en el lado opuesto del cuerpo.
Este fenómeno persistente se mantuvo durante más de seis meses, una duración notable para la escala de vida de un ratón. El hallazgo sugiere que las experiencias dolorosas pueden dejar una “firma fisiológica” duradera, una especie de memoria corporal que sigue influenciando cómo respondemos al entorno, incluso cuando el peligro ya no está presente.
Hormonas del estrés y receptores de alerta: una combinación explosiva
La clave de este mecanismo parece residir en un bucle de retroalimentación entre dos elementos conocidos por su papel en el dolor y el estrés: la hormona corticosterona y el receptor TRPA1. Este último es apodado el “receptor del wasabi” por su capacidad de inducir una sensación de ardor agudo, y es muy activo ante estímulos dolorosos.
En los ratones lesionados, este sistema quedó hiperactivado, intensificando la respuesta al olor del depredador.
El estudio demuestra que el TRPA1 y la corticosterona forman una vía de amplificación del miedo y el dolor. Cuando se bloqueó farmacológicamente cualquiera de los dos componentes durante la exposición al estímulo estresante, la reacción exagerada desapareció. Esto sugiere que el cuerpo mantiene un circuito activo de vigilancia que puede ser desactivado, al menos en modelos animales.
Curiosamente, los investigadores descubrieron que, aunque tanto el miedo como el dolor se intensificaban tras el trauma inicial, no compartían exactamente los mismos mecanismos. La corticosterona fue necesaria para ambos efectos, pero el TRPA1 solo influía en la respuesta de miedo. Esto abre la puerta a tratamientos más específicos que puedan separar la ansiedad del dolor crónico.
Dolor fantasma sin fantasmas: un nuevo tipo de memoria corporal
Los efectos observados no fueron un simple eco del dolor anterior. No hubo nueva lesión ni inflamación activa. El dolor reactivado en los ratones se parecía más a un reflejo emocional, como si el cuerpo recordara el daño y respondiera con anticipación al peligro. Esta sensibilidad aumentada ocurrió incluso en las extremidades que nunca habían sido dañadas, lo que refuerza la idea de una reconfiguración del sistema nervioso central.
Este tipo de “primado del dolor” puede explicar por qué algunas personas desarrollan dolor crónico después de una lesión aparentemente menor.
No se trata de un síntoma imaginario, sino de un cambio real en la forma en que el cuerpo procesa las señales nerviosas. En lugar de resetearse al desaparecer el estímulo, el sistema permanece hiperexcitado, como si hubiera olvidado cómo relajarse.
Esta memoria fisiológica también podría estar en la raíz de ciertos trastornos de ansiedad y estrés postraumático, donde el cuerpo reacciona con miedo o dolor ante señales que no representarían una amenaza para otros. El estudio sugiere que la raíz del problema no está en la mente que imagina, sino en el cuerpo que recuerda.
Una pista para nuevos tratamientos personalizados
Al separar los caminos biológicos que conducen al miedo y al dolor, los investigadores han logrado identificar puntos clave donde sería posible intervenir. Bloquear el receptor TRPA1 redujo el miedo, mientras que inhibir la corticosterona detuvo tanto el miedo como el dolor crónico.
Esto sugiere que es posible desarrollar tratamientos que interrumpan la huella del trauma sin afectar otras funciones del sistema nervioso.
Estas observaciones podrían inspirar nuevas terapias para personas que viven con dolor crónico o ansiedad generalizada tras haber pasado por una experiencia traumática. En lugar de tratar solo los síntomas, estas intervenciones podrían dirigirse a los mecanismos fisiológicos que mantienen al sistema atrapado en modo “alerta”.
Además, este enfoque ayudaría a distinguir entre el dolor físico activo y el dolor persistente inducido por la memoria corporal. Una mejor comprensión de estos circuitos también podría explicar por qué algunos tratamientos convencionales para el dolor tienen un efecto limitado en ciertos pacientes.
El cuerpo como archivo emocional
El experimento llevado a cabo por el equipo de la Universidad de Toronto no solo demuestra la existencia de una memoria somática, sino que plantea una pregunta inquietante: ¿qué otras huellas dejan nuestras experiencias sobre el cuerpo, incluso cuando creemos haberlas superado?
Si las cicatrices invisibles de una lesión física pueden reactivarse ante una señal emocional, los vínculos entre cuerpo y mente son más profundos de lo que pensamos.
Este conocimiento transforma la forma en que entendemos el dolor y la ansiedad. No se trata solo de sensaciones subjetivas o de problemas psicológicos. Se trata de un sistema biológico que, por razones evolutivas, aprendió a protegernos, aunque a veces esa protección se convierta en una trampa.
El estudio también nos invita a repensar la importancia de la prevención y el seguimiento en casos de trauma físico o emocional. Comprender cómo reacciona el cuerpo tras una lesión podría ser la clave para evitar que el dolor y el miedo se conviertan en compañeros permanentes.
Referencias
- Baumbach, J. L., Mui, C. Y., Leonetti, A. M., & Martin, L. J. (2025). A history of injury enhances affective and sensory responses to predator threat by sensitizing corticosterone release through TRPA1 receptor signaling. Current Biology. doi: 10.1016/j.cub.2025.07.005
Cortesía de Muy Interesante
Dejanos un comentario: