Durante una infección, el sistema inmunitario activa sus células más eficaces para eliminar el patógeno. Pero, ¿cómo elige cuáles expandir y cuáles dejar atrás? Un nuevo hallazgo revela que este proceso no termina tras el primer contacto con el antígeno. Existe una segunda fase de activación clave, que selecciona a los linfocitos T más eficientes mediante señales precisas de otras células inmunitarias.
Durante décadas, se pensó que los linfocitos T, fundamentales en la defensa contra virus y células tumorales, requerían una sola fase de activación. Sin embargo, un estudio publicado en Science por un equipo del Max Planck Research Group for Systems Immunology y la Universidad de Würzburg desmiente esa idea.
Los autores identificaron una segunda fase de “priming” o activación de linfocitos T CD8, que resulta crucial para seleccionar y expandir solo a aquellos con mayor afinidad por el antígeno.
Esta segunda etapa ocurre tras una breve pausa en la señalización, unos dos o tres días después del contacto inicial con las células dendríticas (DC). En ella, los linfocitos CD8 de alta afinidad retoman contacto con las DC en zonas específicas del ganglio linfático, recibiendo señales adicionales como la interleucina-2 (IL-2) —una citoquina clave producida por linfocitos T CD4 colaboradores.
Microscopia intravital revela el comportamiento celular oculto
“Hasta ahora, se suponía que solo existía una fase, y las células inicialmente activadas continuaban su función en piloto automático”, dijo el Dr. Wolfgang Kastenmüller, autor principal y parte del grupo de investigación Max Planck para la inmunología sistémica.
“Lo que antes se desconocía, sin embargo, era el proceso por el cual se seleccionan las celdas más adecuadas”.
Los investigadores emplearon microscopía intravital para observar las interacciones entre linfocitos CD8, CD4, reguladores (Treg) y células dendríticas durante una infección viral.
El hallazgo fue sorprendente: los linfocitos CD8 experimentan una segunda fase de contacto prolongado con DCs, pero solo si expresan el receptor CXCR3, que les permite acceder a nichos subfoliculares del ganglio linfático.
Durante esta fase, la fosforilación de STAT5, marcador de señalización por IL-2, aumentaba en los linfocitos CD8, lo que indicaba que recibían soporte directo de los linfocitos CD4. A diferencia de estos, que migran en un patrón de “parar y seguir”, los linfocitos Treg no detenían su movimiento, lo que sugiere que su función reguladora se ejerce mientras circulan, limitando el acceso a IL-2 en el microambiente.
IL-2 paracrina: clave para la selección de clones de alta afinidad
Uno de los hallazgos más relevantes fue que solo los linfocitos CD8 con alta afinidad por el antígeno lograban acceder a esta segunda fase, ya que eran los únicos que se reenganchaban con las DCs.
Esta selección afinada asegura que el sistema inmunitario dedique recursos a expandir clones verdaderamente eficaces, aumentando la eficiencia de la respuesta.
Cuando los investigadores eliminaron específicamente a los linfocitos CD4 colaboradores sin afectar a los Treg, observaron una caída significativa en la proliferación y diferenciación de los CD8. Esto demuestra que la producción de IL-2 por parte de los CD4 es esencial en esta segunda etapa del priming.
“Mientras que la primera fase de cebado sirve para activar una amplia gama de células T específicas, la segunda fase recién identificada es responsable de seleccionar y expandir específicamente aquellas células T que pueden reconocer el patógeno de manera más efectiva,” dijo Katarzyna Jobin, autor y parte del grupo de investigación Max Planck. “Esto asegura que la respuesta inmunitaria esté optimizada para la máxima eficiencia”.
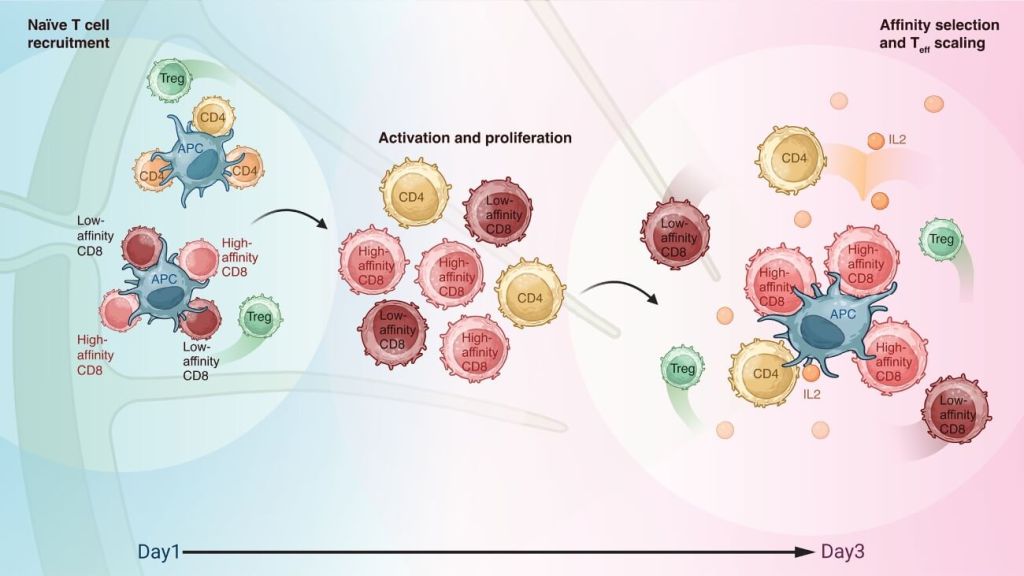
Una coreografía celular que redefine la inmunología
Tradicionalmente, se asumía que tras activarse, los linfocitos T CD8 continuaban su desarrollo sin necesidad de señales adicionales. Pero este estudio propone un modelo en dos fases: la primera activa un repertorio amplio de clones, mientras que la segunda, activa selectivamente a los más eficaces, gracias al soporte paracrino de IL-2 y al reencuentro con células presentadoras de antígeno.
La migración diferenciada de los T CD8, T CD4 y Treg en esta segunda fase es clave. Los CD4 pausan brevemente para liberar IL-2, mientras que los Treg reducen su disponibilidad al circular por la zona, funcionando como moduladores del entorno.
Este equilibrio de señales define cuáles clones CD8 prosperarán como células efectoras.
Implicaciones para vacunas e inmunoterapia
Los hallazgos tienen consecuencias directas para el diseño de vacunas y terapias con células T. La segunda fase del priming podría representar una ventana crítica para potenciar selectivamente a los clones más eficaces, y podría explicar por qué ciertos tratamientos, como las terapias con células CAR-T, fallan si no se replican correctamente estas condiciones del entorno linfático.
En infecciones crónicas y cáncer, donde los linfocitos T sufren activaciones repetidas y agotamiento funcional, entender los mecanismos de esta fase de selección podría ser clave para restablecer una respuesta inmunitaria eficaz.
Un nuevo paradigma en la inmunidad adaptativa
Este estudio redefine lo que sabíamos sobre la activación de linfocitos T. El “priming” no es solo un evento inicial, sino un proceso dinámico, secuencial y altamente regulado, donde las células del sistema inmunitario interactúan de forma compleja para maximizar la eficacia defensiva sin desencadenar autoinmunidad o daños colaterales.
“Esperamos que nuestras nuevas ideas ayuden a profundizar nuestra comprensión de cómo optimizar las terapias basadas en células T, y que arrojen luz sobre por qué estos tratamientos a veces fallan”, dijo Georg Gasteiger, autor y miembro del grupo de investigación.
El trabajo no solo amplía el conocimiento básico de la inmunología, sino que abre vías para desarrollar intervenciones más precisas y potentes en el tratamiento de enfermedades infecciosas y oncológicas.
Referencias
- Jobin, Katarzyna, et al. A distinct priming phase regulates CD8 T cell immunity by orchestrating paracrine IL-2 signals. Science. (2025): doi: 10.1126/science.adq1405
Cortesía de Muy Interesante
Dejanos un comentario: