El cáncer de células de la granulosa es un tipo raro de tumor que representa alrededor del 5% de los cánceres de ovario. Aunque su progresión suele ser lenta, tiende a reaparecer años después del tratamiento inicial, lo que lo convierte en un desafío clínico.
Uno de los descubrimientos clave en este tipo de cáncer fue la identificación de una mutación genética recurrente en el gen FOXL2 (c.402C>G), presente en más del 97% de los casos de este tumor. Recientemente se ha demostrado que esta alteración genética juega un papel crucial en el desarrollo de este tipo de tumores (1), lo que la convierte en diana para el desarrollo de nuevos tratamientos.
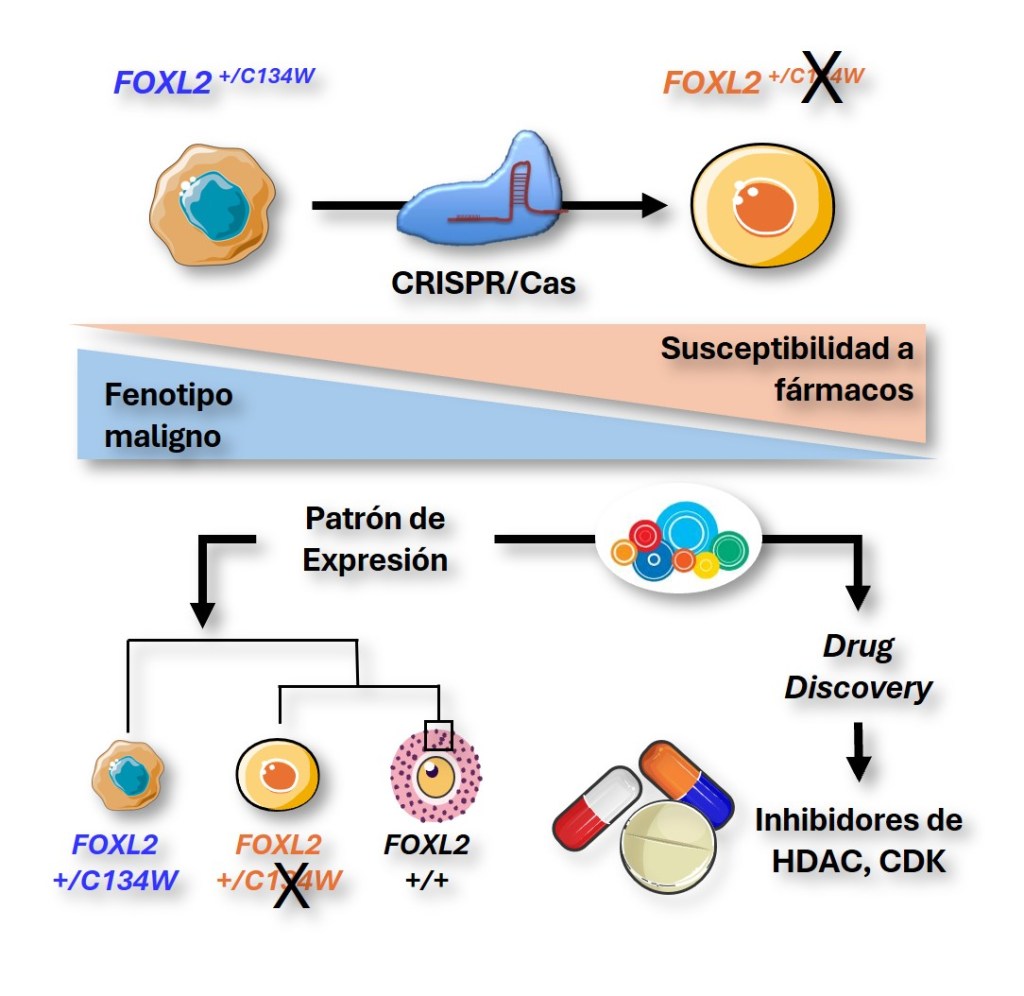
Una investigación reciente de nuestro grupo, desde el Instituto de Investigación de Enfermedades Raras (IIER) del Instituto de Salud Carlos III (ISCIII), y publicada en la revista Molecular Oncology, muestra que el uso de la tecnología CRISPR-Cas9 para eliminar esta mutación genética reduce significativamente la agresividad de las células tumorales (2). CRISPR es una herramienta que permite editar genes, y que está abriendo numerosas posibilidades en el campo de la biotecnología y, de forma específica en el de la biomedicina para avanzar en el tratamiento de las enfermedades humanas (3).
Los resultados de este estudio, realizado en un modelo celular, sugieren que la edición genética podría ser una estrategia prometedora para tratar este tipo de cáncer en el futuro. Los estudios en modelo celular, o in vitro, como el llevado a cabo en este caso, constituyen el primer escalón de la escalera que conduce al desarrollo de nuevas terapias antitumorales. En las siguientes etapas se confirman las pruebas de concepto establecidas en sistemas más complejos, normalmente consistentes en modelos animales. Si estas fases se van superando con éxito, las agencias que regulan el desarrollo de medicamentos permiten plantear ensayos clínicos con personas, que es el último paso antes de conceder la aprobación de la posible terapia para uso humano.
El papel de FOXL2 en el cáncer de células de la granulosa
FOXL2 es un factor de transcripción esencial para el desarrollo y el funcionamiento de los ovarios. En condiciones normales, regula la expresión de genes involucrados en la diferenciación celular y la respuesta al estrés, entre otras actividades, de las células ováricas. Sin embargo, una mutación genética específica, denominada c.402C>G, altera su función y contribuye a la aparición y progresión de este tipo de cáncer. Es importante destacar que la mutación solo se detecta en una de las dos copias del gen.
En el estudio que hemos realizado en el Instituto de Investigación de Enfermedades Raras del ISCIII nos planteamos varias hipótesis de partida. Una de ellas implicaba que la tecnología CRISPR nos iba a permitir destruir de forma específica está mutación, algo que conduciría a la pérdida de expresión de la forma mutada de FOXL2. También nos planteamos que este cambio genético podría conllevar un cambio celular con la desaparición de propiedades malignas. Por último, hipotetizamos que el estudio comparativo de las células editadas mediante CRISPR respecto a las tumorales de las que proceden podría ayudarnos a encontrar nuevas estrategias terapéuticas. Las tres hipótesis nos condujeron a descubrimientos muy interesantes.
CRISPR: un arma letal y específica para la mutación
CRISPR es una herramienta de edición genética generada a partir de un sistema bacteriano de defensa contra infecciones de virus y otras bacterias. Los complejos CRISPR pueden modificar secuencias específicas de ADN gracias a la acción combinada de sus dos componentes principales: una molécula guía de ARN y una endonucleasa que provoca la rotura del ADN de doble cadena. El proceso es algo técnico y complejo: en nuestro estudio diseñamos una guía que incluía la mutación c.402C>G y que, asociada a Cas9, permitía que esta endonucleasa de primera generación produjese roturas de ADN en la secuencia mutante. Estas roturas son corregidas por la maquinaria de reparación celular, de tal forma que en la mayoría de los casos se introducen nuevas mutaciones que provocan la aparición de secuencias de parada de lectura. El resultado final es la expresión de una proteína FOXL2 truncada y que no porta la mutación. El hecho de que no fuéramos capaces de detectar actividad de la maquinaria CRISPR sobre la copia no mutada de FOXL2 constató la especificidad del sistema diseñado.
Resultados prometedores en modelos celulares
Una vez confirmamos nuestra primera hipótesis, pasamos a estudiar cuáles eran los efectos celulares provocados en las células tumorales de la granulosa cuando eliminábamos la mutación en FOXL2. Nuestros resultados mostraron que las células editadas con CRISPR/Cas9 presentaban una menor capacidad de proliferación y migración, lo que indica una reducción en la agresividad del tumor. También detectamos alteraciones en rutas moleculares implicadas en la regulación del crecimiento y la supervivencia celular. Además, las células editadas se mostraron inoperantes cuando fueron inyectadas en peces cebra, un sistema modelo en el que estudiamos in vivo la aparición de células tumorales. Por otro lado, estas células resultaron ser más sensibles a los tratamientos con dasatinib y ketoconazol, dos compuestos químicos que han sido recientemente propuestos como nuevas aproximaciones terapéuticas para el tratamiento de este tipo de tumores. Todos estos resultados sugieren que la mutación c.402C>G en FOXL2 es clave para conferir a las células tumorales de la granulosa propiedades malignas que favorecen la aparición de tumores.
En un último bloque de experimentos, realizamos un estudio profundo de expresión en el que comparamos las células editadas y las tumorales de las que procedían. El análisis masivo a nivel de ARN y proteína nos permitió detectar numerosas rutas moleculares asociadas al desarrollo tumoral. Igualmente, la comparación con resultados previos de expresión en células de la granulosa normales, nos permitió constatar que eliminar esta mutación de las células tumorales podría devolver a las células a un estado muy parecido al que presentan las células de la granulosa normal.
En esta última parte del proyecto, usando herramientas bioinformáticas avanzadas, nos lanzamos a la búsqueda de nuevos compuestos con propiedades antitumorales. En concreto buscamos patrones de expresión génica inducidos por la acción de compuestos ya estudiados y aprobados para su uso en la práctica clínica, que fueran significativamente parecidos a aquellos provocados por la eliminación de la mutación FOXL2 c.402C>G en células tumorales de la granulosa. Tal y como esperábamos, todos los compuestos detectados mediante esta aproximación provocaron los mismos efectos a nivel celular; es decir, presentaron propiedades antitumorales en este tipo de células tumorales.

¿Cuáles son los siguientes pasos? ¿Y los desafíos esperados?
Nuestros resultados confirman que la mutación FOXL2 desempeña un papel clave en la agresividad del tumor, y que su eliminación mediante CRISPR podría representar una estrategia viable para frenar su progresión. Por tanto, nos hemos planteado su validación mediante estudios in vivo. Para ello hemos generado un modelo de ratón portador de la mutación FOXL2 que recapitula la enfermedad humana y, por tanto, funciona como “avatar” de las pacientes de cáncer de la granulosa ovárica.
A pesar de lo prometedor de la estrategia, el uso de CRISPR se enfrenta a un claro desafío. Se precisa una entrega altamente eficaz que llegue a todas las células tumorales ya que las que queden libres de la acción de CRISPR provocarán la reaparición del tumor. Para solventar esta problemática podrán resultar fundamentales los compuestos químicos con potencial terapéutico que hemos descubierto en nuestros estudios bioinformáticos de células tumorales de granulosa editadas. El uso de estos compuestos en combinación con la terapia génica mediada por CRISPR podría resultar definitiva para el tratamiento de estos tumores.
En definitiva, este estudio es una muestra más de las posibilidades que abre la edición genética para tratar enfermedades causadas por mutaciones conocidas en un gen. En este caso, demostramos el potencial de la eliminación de la mutación FOXL2 c.402C>G en células tumorales de la granulosa. Aunque aún queda un largo camino para su aplicación en pacientes, estos hallazgos abren la puerta a investigar posibles nuevas terapias dirigidas basadas en edición genética mediada por CRISPR.
Referencias
- (1) Llano, E., Todeschini, A.L., Felipe-Medina, N., Corte-Torres, M.D., Condezo, Y.B., Sanchez-Martin, M., López-Tamargo, S., Astudillo, A., Puente, X.S., Pendas, A.M., et al. (2023). The Oncogenic FOXL2 C134W Mutation Is a Key Driver of Granulosa Cell Tumors. Cancer Res. 83, 239–250. https://doi.org/10.1158/0008-5472.CAN-22-1880.
- (2) Amarilla-Quintana, S., Navarro, P., An Hern Andez, I., Ramos, A., Montero-Calle, A., Cabezas-Sainz, P., Barrero, M.J., Ias, D.M., Vilaplana-Mart, B., Epifano, C., et al. (2025). CRISPR targeting of FOXL2 c.402C>G mutation reduces malignant phenotype in granulosa tumor cells and identifies anti-tumoral compounds. Mol. Oncol. https://doi.org/10.1002/1878-0261.13799.
- (3) Doudna, J.A. (2020). The promise and challenge of therapeutic genome editing, Nature, https://doi.org/10.1038/s41586-020-1978-5.

Ignacio Pérez de Castro
Dr. en Ciencias Biológicas por la Universidad Autónoma de Madrid e Investigador Científico del Instituto de Salud Carlos III

Cortesía de Muy Interesante
Dejanos un comentario:
