Los trastornos neurológicos suponen una inmensa carga económica y social para nuestra sociedad, afectando directamente a más de un tercio de todos los europeos, de acuerdo a un informe del Consejo Europeo del Cerebro (1). Según la OMS, son responsables del mayor número de años de vida perdidos por discapacidad en Europa. Se estima que, por sí solos, los trastornos neurológicos representan casi el 50 % del presupuesto sanitario anual en Europa, unos 800.000 millones de euros anuales (2).
Trastornos del neurodesarrollo: ¿son cada vez más frecuentes?
El desarrollo del cerebro humano es el resultado de una compleja interacción entre genes y medioambiente, en los que intervienen múltiples factores que no actúan de manera aislada, sino que se influyen mutuamente a lo largo de toda la vida, especialmente durante la etapa prenatal y la infancia. Cuando alguno (o varios) de estos factores está(n) alterado(s), puede(n) dar lugar a afecciones neurológicas como el trastorno del espectro autista (TEA), el trastorno por déficit de atención e hiperactividad (TDAH), la discapacidad intelectual, la epilepsia o la esquizofrenia, entre otros.
En muchos de ellos, el número de casos ha ido en aumento a lo largo de las últimas décadas, afectando actualmente al 1-2 % de la población (según el país) en el caso del TEA y al 5 % para el TDAH. Se han propuesto diferentes causas para explicar este incremento:
- Mejora en los métodos de diagnóstico: El avance en las herramientas y criterios diagnósticos ha permitido identificar más casos, especialmente en etapas tempranas de la infancia.
- Mayor conciencia y formación profesional: La sensibilización social sobre los trastornos del neurodesarrollo y la capacitación de profesionales de la salud y la educación han facilitado una detección más precisa y oportuna.
- El medio ambiente: el aumento de la edad parental, ciertas complicaciones durante el embarazo como infecciones o parto prematuro, el estrés y la exposición a contaminantes ambientales durante el desarrollo pueden aumentar el riesgo de sufrir trastornos del neurodesarrollo (3).
Trastornos del neurodesarrollo: ¿por qué afectan más a los varones?
Algunos trastornos del neurodesarrollo tienen un sesgo de sexo muy definido; se estima que el TDAH es dos veces más frecuente en hombres que en mujeres, y hasta 4 veces en el caso del TEA. Las razones de estas diferencias no se conocen con certeza, aunque se han postulado diversos factores genéticos y ambientales implicados. Por ejemplo, existen numerosos genes asociados a los cromosomas sexuales que regulan el desarrollo del cerebro y que se encuentran expresados (es decir, son funcionales) en distinta proporción según el sexo. Así, se estima que el 20 % de los genes situados en el cromosoma X están directamente relacionados con los trastornos del neurodesarrollo, como por ejemplo el gen responsable del “Síndrome del X frágil” (4). En las mujeres, las mutaciones en este gen podrían estar compensadas por la otra copia del gen (del otro cromosoma X) no mutada.
Por otro lado, ciertos genes presentes en el cromosoma Y (exclusivo del sexo masculino), podrían conferir mayor riesgo de sufrir trastornos del neurodesarrollo, aunque las evidencias al respecto son limitadas. Otras teorías se basan en la producción fetal de testosterona, hormona sexual masculina responsable de la masculinización del cerebro durante la etapa prenatal, y cuya producción excesiva en algunos pacientes con TEA podría causar alteraciones en el neurodesarrollo (5). No obstante, hay que tener en cuenta que el sexo femenino ha estado infrarrepresentado en muchos estudios científicos y su perfil sintomatológico podría no ajustarse a los criterios diagnósticos tradicionalmente basados en varones, lo que en conjunto ha podido contribuir a su menor diagnóstico en los trastornos del neurodesarrollo.

Factores genéticos: el caso de las RASopatías
Se estima que 1 de cada 15 personas de la población, más de 3 millones de personas en España, padecen alguna enfermedad rara o no tienen diagnóstico. Las RASopatías son un grupo de enfermedades genéticas del desarrollo, que se caracterizan por presentar mutaciones en genes de la vía de señalización celular Ras/MAPK. A pesar de ser consideradas enfermedades raras, las RASopatías son, en conjunto, el grupo de trastornos del neurodesarrollo con mayor incidencia en la población, afectando a 1 de cada 1000 nacimientos (6).
Aunque con características propias de cada síndrome, los distintos tipos de RASopatías comparten varios síntomas comunes como anomalías craneofaciales, alteraciones en la piel, baja estatura, problemas cardíacos, así como mayor propensión a desarrollar cáncer y a sufrir trastornos del neurodesarrollo. Entre las más comunes, están el síndrome de Noonan y la Neurofibromatosis de tipo I (NF1). A pesar de la variabilidad existente entre pacientes, debida a distintas mutaciones y genes afectados, aproximadamente un tercio de los pacientes con síndrome de Noonan o con NF1 son diagnosticados con TEA y casi la mitad de ellos sufren TDAH, siendo por tanto entre 5 y 10 veces más frecuentes que en la población general (7,8). En otros síndromes, como el cardiofaciocutáneo (CFC) y el de Costello, la prevalencia de trastornos del neurodesarrollo es aún mayor y suele llevar asociada discapacidad intelectual (9). No obstante, aún se sabe poco acerca de los mecanismos biológicos que causan estas alteraciones del neurodesarrollo en los pacientes con RASopatías.
Investigaciones recientes de nuestro laboratorio indican que las isoformas (o variantes) de la proteína Ras, como H-Ras y K-Ras (e implicadas en los síndromes de Costello y Noonan/CFC, respectivamente) tienen funciones diferenciadas en el cerebro y regulan procesos tan importantes como la plasticidad sináptica (10), que es un mecanismo fisiológico que controla la comunicación entre las neuronas y está implicado en la memoria y el aprendizaje. Estos descubrimientos podrían abrir nuevas vías de estudio para comprender mejor las RASopatías y los trastornos neurológicos asociados.
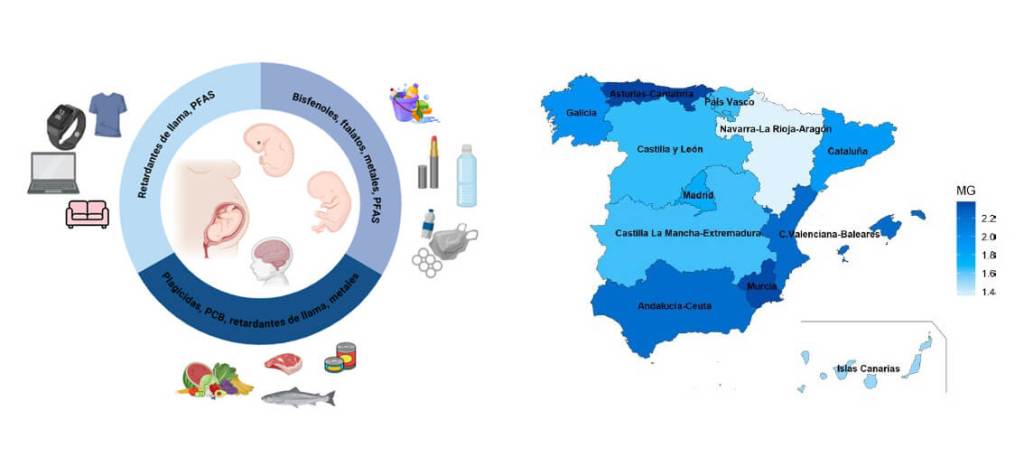
Factores ambientales: el caso de la exposición a contaminantes neurotóxicos.
Se estima que hay más de 100.000 sustancias químicas comercializadas, sin contar con las que se generan como productos secundarios derivados de procesos industriales y de la actividad humana. De todas ellas, más de 200 han demostrado ser neurotóxicas en humanos, aunque la gran mayoría aún no han sido testadas (11).
Durante el embarazo, muchos de estos compuestos se transfieren de la madre al feto a través de la placenta. Dado que el cerebro en desarrollo es extremadamente sensible y vulnerable a las sustancias químicas tóxicas, incluso a niveles de exposición bajos que podrían considerarse seguros para los adultos, estos compuestos pueden interferir con los procesos biológicos cerebrales y aumentar el riesgo de sufrir trastornos relacionados con el neurodesarrollo (12).
Se pueden establecer tres grupos principales de contaminantes ambientales con evidencias de afectar al neurodesarrollo:
1.- Metales pesados como el mercurio, metilmercurio, plomo, arsénico, manganeso o cadmio, algunos de los cuales se han asociado con mayor riesgo de sufrir TEA y TDAH en niños (13).
2.- Contaminantes orgánicos persistentes, como los plaguicidas, los bifenilos policlorados (PCB) y los retardantes de llama bromados y fosforados son considerados neurotóxicos. Aunque en muchos casos su producción y uso están prohibidos o restringidos desde hace años, a día de hoy, se siguen detectando en la población general debido a su elevada persistencia en el medio ambiente y a uso masivo en el pasado (14). Mención especial merecen los compuestos perfluorados (PFAS), denominados coloquialmente “los químicos eternos”, que atraen gran interés de la comunidad científica debido a: i) su toxicidad, especialmente en el neurodesarrollo (15), ii) su presencia en multitud de productos de alto consumo y iii) su regulación, limitada a un pequeño grupo de compuestos (entre los más de 4000 que conforman la familia de los PFAS).
3.- Compuestos no persistentes. Aunque presentan tiempos de vida cortos en nuestro organismo, ya que son metabolizados y eliminados con rapidez, estamos expuestos de forma permanente a ellos dada su presencia como aditivos en plásticos de uso común. Dentro de este grupo, se ha descrito actividad neurotóxica para algunos derivados de plásticos como los ftalatos y los bisfenoles (16).
Una herramienta fundamental para evaluar la exposición a contaminantes son los estudios de biomonitorización humana (HBM, en inglés). En ellos, se selecciona una muestra poblacional y se determina el nivel de exposición a contaminantes ambientales mediante el análisis de sus concentraciones en sangre, orina, cabello o en cualquier otra matriz biológica que sea idónea. Los estudios de HBM además permiten identificar poblaciones vulnerables y evaluar tendencias temporales. Esto, junto con información sobre estilos de vida, entorno o dieta que se recoge de los voluntarios, permite estudiar fuentes de exposición a estos compuestos tóxicos y proponer medidas correctoras (14). Por tanto, los estudios de HBM proporcionan información muy valiosa sobre la efectividad de las políticas medioambientales adoptadas y pueden servir como apoyo a aquellas pendientes de implementar.
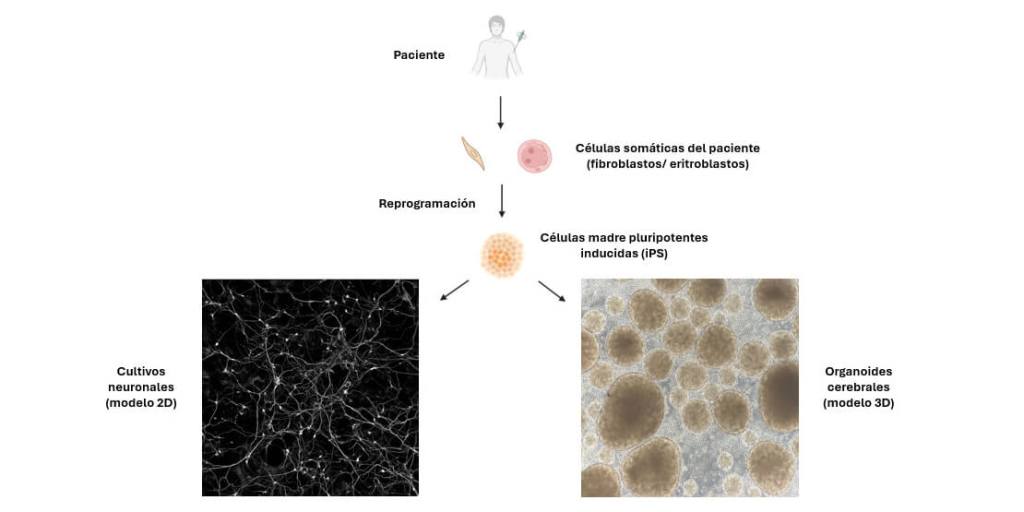
Nuevos modelos celulares para el estudio del neurodesarrollo
Históricamente, los modelos animales han sido la herramienta de referencia para el estudio de las patologías humanas, incluidas aquellas que afectan al neurodesarrollo. Estos modelos son fundamentales para la comprensión de funciones clave del cerebro como el aprendizaje, la memoria, la plasticidad sináptica o el establecimiento de circuitos neuronales (17). Sin embargo, a su vez, presentan distintas limitaciones como su escasa reproducibilidad técnica o su limitada capacidad para predecir respuestas clínicas humanas (18). Además, el uso de animales se encuentra cada vez más regulado por el principio de las 3Rs (reemplazo, reducción y refinamiento) que promueve una sustitución progresiva de los animales en investigación (Directiva 2010/63/UE) por cuestiones éticas obvias.
En este contexto y durante los últimos años, los modelos celulares derivados de células madre han revolucionado el estudio de las enfermedades humanas ofreciendo nuevas herramientas que permiten investigar los mecanismos celulares y moleculares implicados en diversas patologías. Entre estos, las células madre pluripotentes inducidas (iPS) (19) han tomado especial relevancia por diversos motivos: i) su sencilla obtención a partir de células somáticas (no reproductoras) de pacientes, como los fibroblastos de la piel o los eritrocitos de la sangre, y ii) su capacidad para diferenciarse a cualquier tipo celular, incluidas las neuronas y las células gliales del cerebro. Esto ofrece la posibilidad de estudiar paso a paso el proceso de neurodesarrollo humano en el contexto genético específico del paciente.
Desde la publicación del primer protocolo para la generación de organoides cerebrales a partir de iPS, el campo ha evolucionado velozmente pasando en unos años de estructuras más desorganizadas e inespecíficas a organoides de una alta complejidad y especificidad. Actualmente, es posible generar organoides cerebrales que reproducen con gran fidelidad la arquitectura y microambiente de regiones específicas del cerebro como el mesencéfalo, la corteza cerebral o el cerebelo. Estos modelos permiten estudiar procesos como la migración celular, la formación de las distintas capas corticales y la conectividad neuronal. Además, se posicionan como plataformas prometedoras para el estudio de diversas patologías, así como para la identificación de dianas terapéuticas, el cribado y validación de fármacos, y el estudio de los efectos tóxicos de los contaminantes ambientales en el desarrollo cerebral (20).
Finalmente, la incorporación de tecnologías complementarias como la edición génica, los sistemas de co-cultivos con distintos tipos celulares o la fusión de organoides (conocidos como asembloides) abren un prometedor horizonte para la modelización de enfermedades complejas en entornos cada vez más fisiológicos y representativos del cerebro humano.
En definitiva, los avances recientes en los campos de la toxicología ambiental y de la biomedicina nos permitirán estudiar y conocer cada vez mejor cómo interaccionan los factores genéticos y ambientales en el desarrollo del cerebro. A su vez, estos conocimientos nos servirán no solo para entender mejor las alteraciones neuropatológicas que dan lugar a la aparición de trastornos como el TEA o el TDAH, sino que también contribuirán a proporcionar nuevas herramientas y metodologías para abordar el tratamiento y la prevención de estas afecciones neurológicas.
Referencias
- (1) Wittchen HU, Jacobi F, …, Steinhausen HC. The size and burden of mental disorders and other disorders of the brain in Europe 2010. Eur Neuropsychopharmacol (2011). doi: 10.1016/j.euroneuro.2011.07.018
- (2) Gustavsson A, Svensson M, …, Olesen J. Cost of disorders of the brain in Europe 2010. Eur Neuropsychopharmacol (2011). doi: 10.1016/j.euroneuro.2011.08.008
- (3) Modabbernia A, Velthorst E, Reichenberg A. Environmental risk factors for autism: an evidence-based review of systematic reviews and meta-analyses. Molecular Autism (2017). doi: 10.1186/s13229-017-0121-4
- (4) Brand BA, Blesson AE, Smith-Hicks CL. The Impact of X-Chromosome Inactivation on Phenotypic Expression of X-Linked Neurodevelopmental Disorders. Brain Sci (2021) doi: 10.3390/brainsci11070904
- (5) Baron-Cohen S, Lombardo MV, …, Knickmeyer R. Why are Autism Spectrum conditions more prevalent in Males? PLoS Biol (2011). doi: 10.1371/journal.pbio.1001081
- (6) Rauen, K. A. The RASopathies. Annu Rev Genomics Hum Genet (2013). doi: 10.1146/annurev-genom-091212-153523
- (7) Geoffray MM, Falissard B, …, Garg S. Autism Spectrum Disorder Symptom Profile Across the RASopathies. Front. Psychiatry (2021). doi: 10.3389/fpsyt.2020.585700
- (8) Naylor PE, Bruno JL, …, Green T. Neuropsychiatric phenotypes in children with Noonan syndrome. Dev Med Child Neurol (2023). doi: 10.1111/dmcn.15627
- (9) Wingbermühle E, Roelofs RL, …, Egger JIM. Cognitive Phenotype and Psychopathology in Noonan Syndrome Spectrum Disorders through Various Ras/MAPK Pathway Associated Gene Variants. J. Clin. Med (2022). doi: 10.3390/jcm11164735
- (10) López-Merino E, Fernández-Rodrigo A, …, Briz V. Different Ras isoforms regulate synaptic plasticity in opposite directions. EMBO J. (2025) doi:10.1038/s44318-025-00390-8
- (11) Landrigan PJ. What causes autism? Exploring the environmental contribution. Curr Opin Pediatr (2010). doi:10.1097/MOP.0b013e328336eb9a
- (12) López-Merino E, Cuartero MI, Esteban JA, Briz V. Perinatal exposure to pesticides alters synaptic plasticity signaling and induces behavioral deficits associated with neurodevelopmental disorders. Cell Biol Toxicol (2022). doi: 10.1007/s10565-022-09697-2
- (13) Skogheim TS, Weyde KVF, …, Villanger GD. Metal and essential element concentrations during pregnancy and associations with autism spectrum disorder and attention-deficit/hyperactivity disorder in children. Environ Int (2021). doi: 10.1016/j.envint.2021.106468
- (14) Ramos JJ, Huetos O, …, Castaño A. Organochlorinated pesticides levels in a representative sample of the Spanish adult population: The Bioambient.es project. Int J Hyg Environ Health (2017). doi: 10.1016/j.ijheh.2016.10.005
- (15) Luo F, Chen Q, …, Zhang J. Exposure to perfluoroalkyl substances and neurodevelopment in 2-year-old children: A prospective cohort study. Environ Int (2022). doi: 10.1016/j.envint.2022.107384
- (16) Minatoya M, Kishi R. A Review of Recent Studies on Bisphenol A and Phthalate Exposures and Child Neurodevelopment. Int J Environ Res Public Health (2021). doi: 10.3390/ijerph18073585
- (17) Briz V, Restivo L, Pasciuto E, …, Bagni C. The non-coding RNA BC1 regulates experience-dependent structural plasticity and learning. Nat Commun (2017). doi: 10.1038/s41467-017-00311-2
- (18) Zhao X, Bhattacharyya A. Human Models Are Needed for Studying Human Neurodevelopmental Disorders. Am J Hum Genet (2018). doi: 10.1016/j.ajhg.2018.10.009
- (19) Lancaster MA, Renner M, Martin CA, …, Knoblich JA. Cerebral organoids model human brain development and microcephaly. Nature (2013). doi: 10.1038/nature12517
- (20) Hu C, Yang S, …, Liang G. Organoids and organoids-on-a-chip as the new testing strategies for environmental toxicology-applications & advantages. Environ Int (2024). Doi: 10.1016/j.envint.2024.108415. doi: 10.1016/j.envint.2024.108415.

Víctor Briz Herrezuelo
Dr. en Biomedicina (2011) por la Universidad de Barcelona y licenciado en Química (2004) y Bioquímica (2007) por la Universidad Autónoma de Madrid


Andrea Peña López
Graduada en Farmacia, Máster Universitario en Terapias Avanzadas en Biomedicina


Juan José Ramos Rodríguez
Científico Titular. Dr. Ciencias Químicas

Cortesía de Muy Interesante
Dejanos un comentario:

