La investigación biomédica, veterinaria y medioambiental se ha basado tradicionalmente en el uso de modelos animales como son los mamíferos (ratas, ratones, cobayas, etc.). Estos modelos permiten a los investigadores estudiar de manera controlada procesos relacionados con enfermedades, así como los efectos de fármacos previos a su aceptación en uso humano. Estos mamíferos también nos han servido para evaluar efectos tóxicos de sustancias que se liberan al medio ambiente intencionalmente, como los pesticidas, o como subproducto de la industria humana, como los metales pesados.
En las últimas décadas, debido a cuestiones económicas, pero sobre todo a cuestiones éticas, hay una necesidad de disminuir el número de mamíferos utilizados en la experimentación. Inclusive, la UE está liderando la transición mediante una hoja de ruta para implementar métodos no animales para la valoración toxicológica y farmacológica de productos químicos. Así, hemos visto un auge en el desarrollo de otros modelos como pueden ser los cultivos celulares o los organoides que tienen múltiples ventajas, pero también algunos inconvenientes. El principal problema de estos sistemas llamados “in vitro” es que suelen modelar un tejido u órgano específico y carecen de una integración en sistemas o de animal completo.
Ante esta carencia, el modelo de embrión de pez cebra, como un organismo completo, surge hace unos años como una alternativa muy interesante, ya que es un vertebrado que comparte el 70 % de genes con los humanos y dado que hasta los 5 días de vida se considera legalmente una alternativa a la experimentación animal por su bajo nivel de sensación de dolor (Strähle et al., 2012).

¿De dónde viene este modelo?
El pez cebra (Danio rerio) es un animal oriundo de aguas dulces del sur de Asia (India, Pakistán y alrededores). Fue descrito por primera vez por el médico escocés Francis Hamilton, quien lo describió como un “pez bellísimo” con rayas azules y plateadas en los lados de su cuerpo. Esta particularidad fue crucial para bautizarlo como el pez cebra (Hamilton, 1822). Su pequeño tamaño, su atractivo visual y su fácil adaptación a diferentes condiciones de vida hizo que a principios del siglo XX se comenzara a criar como pez ornamental en acuarios domésticos. Posteriormente, fue a partir de la década de los ochenta que dio el salto al laboratorio gracias al trabajo pionero de George Streisinger (Universidad de Oregon) quien lo propuso como modelo en estudios genéticos y del desarrollo embrionario debido a sus ventajosas características (Streisinger et al., 1981).
Características principales
El pez cebra en la naturaleza puede vivir en un rango de condiciones muy amplio de temperatura, acidez y salinidad (Arunachalam et al., 2013). En el laboratorio esta es una ventaja, ya que es un pez que se adapta fácilmente a condiciones experimentales diversas, según las necesidades del investigador. Presenta dimorfismo sexual, siendo los machos de color dorado y cuerpo alargado, mientras que ellas son de color plateado y con un abultado abdomen, signo de la cantidad de huevos que producen en su interior. En la naturaleza, el pez cebra se reproduce al amanecer en aguas poco profundas y con vegetación que permite el escondite de los cientos de huevos que pone la hembra. El macho persigue a la hembra y, con su cola, presiona ligeramente su abdomen para estimular la puesta a la vez que libera millones de espermatozoides al agua. Este tipo de fecundación externa, y la abundante puesta de huevos, son características cruciales para su uso en el laboratorio. En este entorno, la cantidad de embriones de pez cebra producidos por una sola hembra puede ascender hasta los 100 o 200, siendo este rasgo esencial si se quieren repetir los experimentos muchas veces para confirmar los resultados.

El embrión de pez cebra es pequeño, pero perceptible a simple vista y se asemeja al huevo de una gallina, con una cubierta protectora llamada corion y una yema sobre la cual crecen las células que darán lugar al animal completo. En este caso, sin embargo, el corión y las células son transparentes, lo cual facilita su observación mediante el uso de lupas simples de laboratorio. El embrión empieza por una sola célula, producto de la fecundación del óvulo por el esperma, que rápidamente se divide y multiplica, formando un acúmulo de miles de células en pocas horas. A las 24 horas tras su fecundación, el embrión está formado y se vislumbran en él la cabeza, los ojos y la cola. Esta se desprende de la yema y comienza a moverse realizando coletazos rápidos que indican que los músculos se van conectando con el sistema nervioso. Es maravilloso para los que trabajamos con este organismo el ver que en tan pocas horas puede pasar de la “nada” a ser un animal completo en movimiento.
El desarrollo embrionario del pez cebra se asemeja mucho al de otros vertebrados, incluyendo los humanos. Esto no es de extrañar dado que este animal comparte aproximadamente el 70 % de los genes con nosotros. Más importante aún, alrededor del 80 % de genes de enfermedades humanas tienen un paralelo en el pez cebra. Su genoma fue secuenciado en el año 2013 por un consorcio compuesto por varios investigadores (Howe et al., 2013) y esto generó un gran impacto en la biología y biomedicina porque impulsó el uso del pez cebra como modelo. Entre otras cosas, el conocimiento de los genes de este animal promovió la creación de líneas transgénicas para el estudio de diversas enfermedades (Hwang et al., 2013). Por otro lado, se crearon bases de datos que facilitaron la comparación de los genes del pez cebra con los de otros modelos mamíferos o el ser humano (Ruzicka et al., 2018). Todo esto aumentó la confianza en el pez cebra como modelo preclínico y ayudó a que muchos investigadores decidieran utilizarlo en reemplazo de ratones y ratas para estudios de diversas enfermedades y estudios de farmacología y toxicología (MacRae and Peterson, 2015).
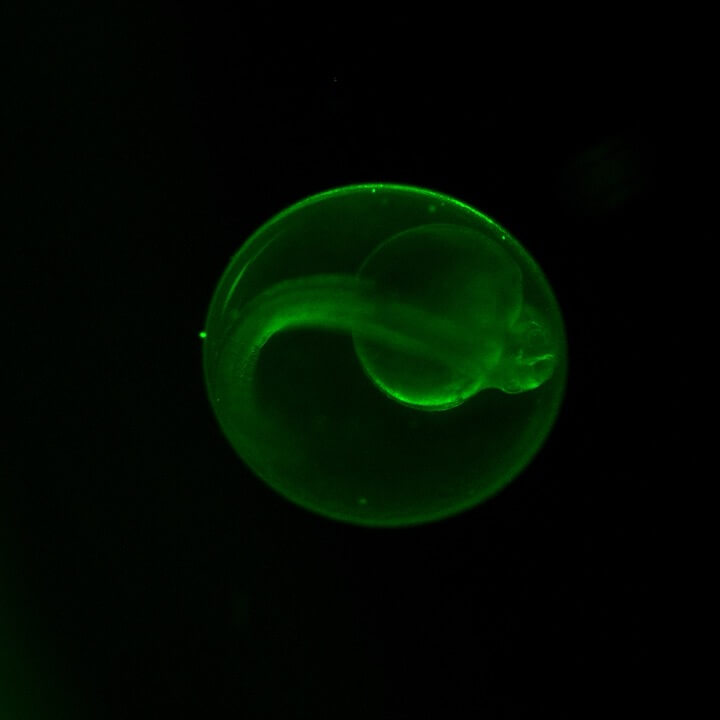
Ventajas con respecto a modelos de mamíferos
El embrión de pez cebra posee múltiples ventajas frente al ratón o rata como modelo de investigación. En primer lugar, su rápido desarrollo, con órganos funcionales entre 24 y 72 horas y su transparencia —que permite observarlos sin necesidad de someterlos a ningún procedimiento ni sacrificio— es una ventaja grande frente a los mamíferos cuyo desarrollo es interno y dura aproximadamente tres semanas (Kimmel et al., 1995). Por otro lado, su alta fecundidad permite realizar mayor número de experimentos en menos tiempo, lo cual mejora el poder estadístico de los resultados, mientras que los ratones/ratas tienen camadas de 6-12 crías. En términos de costes de mantenimiento, el pez cebra tiene una amplia ventaja, ya que los acuarios ocupan mucho menos espacio por animal que las jaulas de los roedores y su alimentación y cuidado se pueden automatizar, disminuyendo el coste de personal necesario (Kohale, 2021).
Otra ventaja importante del modelo es la facilidad de producción de líneas transgénicas y sobre todo de mutantes transitorios. El procedimiento para crear embriones que tengan una proteína de interés silenciada, imitando una enfermedad humana, es muy sencillo y rápido mediante microinyección en la yema (Bill et al., 2009). Estas técnicas son mucho más lentas y costosas e inclusive inviables en modelos de mamífero.
Asimismo, la posibilidad de automatización en los experimentos es una de las grandes ventajas que presenta el trabajar con el embrión de pez cebra. Existen actualmente tecnologías punteras que agilizan el manejo y la colocación de cientos de embriones en placas de ensayo y sistemas de microscopía avanzados para escanear múltiples larvas con software de inteligencia artificial capaces de analizar las imágenes y vídeos, facilitando inclusive el conteo de células dentro del embrión (Otterstrom et al., 2022). Este nivel de escala de experimentos sería imposible con los modelos tradicionales.

Usos actuales del embrión de pez cebra en investigación
En biomedicina, para entender el funcionamiento de nuestros órganos —tanto cuando están sanos como cuando sufren alguna enfermedad— es necesario hacer estudios sobre los mecanismos de funcionamiento de las células, como se comunican entre ellas, etc. En este sentido, el pez cebra viene sirviendo como un excelente modelo para el estudio de diversas disciplinas como la cardiología, la neurología, la inmunología, la oncología o la toxicología (entre otras).
En cardiología, el pez cebra ha servido para estudiar el desarrollo del corazón de los vertebrados y demostrar la función de genes y proteínas específicas (como por ejemplo la troponina cardiaca), esenciales para el desarrollo del corazón y la contracción cardiaca (Sehnert et al., 2002). Asimismo, el uso de embriones transgénicos ha permitido el estudio y la mejor comprensión de enfermedades como las arritmias y la cardiomiopatía, así como el cribado de sustancias que pueden ejercer efectos cardioprotectores (Gauvrit et al., 2022; Kithcart and MacRae, 2017).
En neurología, este modelo es ideal, ya que presenta estructuras cerebrales y neurotransmisores muy similares a los humanos. Ha ayudado al mapeo de circuitos neuronales y sensoriales completos, así como a entender la relación entre diversos genes y la función neuronal (Ahrens et al., 2013). Por otro lado, el embrión en estas etapas se puede utilizar también en estudios de comportamiento, ya que a partir de los tres días de vida presenta un nado libre que permite analizar sus movimientos ante distintos estímulos. Estos estudios ayudan a determinar los mecanismos de enfermedades como la epilepsia o trastornos del neurodesarrollo como el TDAH o el autismo, entre otras (Tayanloo-Beik et al., 2022). El embrión de pez cebra también contribuye al estudio de enfermedades neurodegenerativas como el Alzheimer o el Parkinson y permite el estudio a gran escala de posibles sustancias neuroprotectoras (Razali et al., 2021).
En inmunología, el embrión de pez cebra ha servido para entender mejor el sistema inmunitario innato, que es la primera línea de defensa ante ataques externos. Por ejemplo, ha ayudado a determinar el origen, la migración y el comportamiento de los macrófagos, un tipo de glóbulo blanco que es capaz de “ingerir” elementos extraños como bacterias y virus. Asimismo, líneas transgénicas han ayudado a entender los procesos de inflamación en vivo, ya que la transparencia del embrión permite la observación del comportamiento de las células inmunes en tiempo real (Renshaw et al., 2006). Por otro lado, en la era de la ultra resistencia bacteriana a los antibióticos, este modelo está permitiendo la evaluación a gran escala de los efectos de nuevos fármacos ante infecciones tanto locales como sistémicas (Widder et al., 2024).

En el estudio del cáncer, tanto a nivel molecular como de posibles tratamientos, el embrión de pez cebra está siendo cada vez más utilizado. Gracias a su transparencia, es fácil observar en tiempo real procesos como el crecimiento tumoral, la creación de vasos sanguíneos que alimentan el tumor o la metástasis. Estudios recientes muestran la versatilidad de este modelo para avanzar en la investigación contra el cáncer. Como ejemplo, está el caso de tumores de piel (melanoma), para los que se han podido evaluar fármacos que ya están en fases preclínicas (Fernandez del Ama et al., 2016). Otro ejemplo es el de un tumor cerebral agresivo, llamado Glioblastoma, para el cual se han creado avatares en embriones de pez cebra utilizando células de cáncer humano, pudiendo estudiar así el efecto de fármacos en su tratamiento (Tao et al., 2025). Más importante aún es el reciente uso de este modelo para crear avatares de cáncer de pacientes reales, mediante el cual se puede evaluar los efectos de distintos tipos de quimioterapia para determinar la mejor en el caso de cada persona (Mendes et al., 2025). Este tipo de medicina personalizada es el futuro del tratamiento oncológico y el embrión de pez cebra jugará un papel muy importante.
Por otro lado, este modelo lleva siendo utilizado en la determinación de toxicidad de sustancias químicas desde hace muchos años (Dai et al., 2014). En un primer momento, se utilizó para evaluar efectos en el medio ambiente, pero recientemente se ha empezado a valorar su importancia para determinar los efectos de tóxicos en el ser humano. La salud ambiental está íntimamente ligada a la salud humana y cada vez más se reconocen los efectos de sustancias como los pesticidas, plastificantes o microplásticos en procesos como la actividad hormonal, el cáncer o el neurodesarrollo. El embrión de pez cebra es un modelo ideal dado que se pueden evaluar en él efectos a nivel genético, morfológico y de comportamiento a gran escala, determinando en poco tiempo las consecuencias de la exposición ambiental de muchas sustancias en cientos de embriones. Esto sería inviable en modelos de mamíferos como la rata o el ratón.
En el Centro Nacional de Sanidad Ambiental, el laboratorio de Embrión de Pez Cebra, del cual es responsable la autora de este artículo, se centra en estos estudios. En nuestro laboratorio se han evaluado, utilizando este modelo, los efectos de sustancias como el mercurio, los nanoplásticos e inclusive las consecuencias a la exposición de radiofrecuencias de teléfonos móviles, con resultados sumamente interesantes y relevantes para la salud humana.

El futuro de la investigación con este modelo
En los próximos años, el embrión de pez cebra será uno de los mayores protagonistas en los laboratorios de medicina a nivel mundial, dadas sus ventajosas características y la necesidad de disminuir los estudios con mamíferos. Las nuevas tecnologías como los sistemas robóticos, la microscopía avanzada o la inteligencia artificial prometen ser claves en impulsar este modelo al permitir el estudio de miles de embriones simultáneamente. Esto promete acelerar el conocimiento sobre cómo funciona nuestro cuerpo, así como el descubrimiento de fármacos para tratar diversas enfermedades. Más aún, el pez cebra será clave en determinar cómo el medio ambiente y la exposición a sustancias químicas pueden afectar nuestra salud, los procesos de desarrollo embrionario o el envejecimiento.
Proyectos pioneros como el recientemente publicado Zebrahub ya han logrado estudiar a nivel de cada célula cómo este organismo se desarrolla, algo inimaginable hace apenas unos años (Lange et al., 2024). Por otro lado, el uso de nuevas técnicas como el cultivo de organoides derivados de pez cebra permitirá mejorar nuestra comprensión de enfermedades del corazón, del cerebro y de procesos oncológicos. Todo esto apunta a que este pequeño “pez bellísimo” seguirá siendo esencial para salvar vidas humanas, al ser un puente entre la investigación básica y la médica.
Referencias
- Ahrens M.B., Orger M.B., Robson D.N., Li J.M., Keller P.J., 2013. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nat. Methods; 10: 413-20. doi: 10.1038/nmeth.2434
- Arunachalam M., Raja M., Vijayakumar C., Malaiammal P., Mayden R.L., 2013. Natural History of Zebrafish (Danio rerio) in India. Zebrafish; 10: 1-14. doi: 10.1089/zeb.2012.0803
- Bill B.R., Petzold A.M., Clark K.J., Schimmenti L.A., Ekker S.C., 2009. A primer for morpholino use in zebrafish. Zebrafish; 6: 69-77. doi: 10.1089/zeb.2008.0555
- Dai Y.-J., Jia Y.-F., Chen N., Bian W.-P., Li Q.-K., Ma Y.-B., et al., 2014. Zebrafish as a model system to study toxicology. Environmental Toxicology and Chemistry; 33: 11-17. doi: 10.1002/etc.2406
- Fernandez del Ama L., Jones M., Walker P., Chapman A., Braun J.A., Mohr J., et al., 2016. Reprofiling using a zebrafish melanoma model reveals drugs cooperating with targeted therapeutics. Oncotarget; 7.
- Gauvrit S., Bossaer J., Lee J., Collins M.M., 2022. Modeling Human Cardiac Arrhythmias: Insights from Zebrafish. J Cardiovasc Dev Dis; 9. doi: 10.3390/jcdd9010013
- Hamilton F., 1822. An account of the fishes found in the river Ganges and its branches. Vol 1: Archibald Constable.
- Howe K., Clark M.D., Torroja C.F., Torrance J., Berthelot C., Muffato M., et al., 2013. The zebrafish reference genome sequence and its relationship to the human genome. Nature; 496: 498-503. doi: 10.1038/nature12111
- Hwang W.Y., Fu Y., Reyon D., Maeder M.L., Tsai S.Q., Sander J.D., et al., 2013. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat. Biotechnol.; 31: 227-229. doi: 10.1038/nbt.2501
- Kimmel C.B., Ballard W.W., Kimmel S.R., Ullmann B., Schilling T.F., 1995. Stages of embryonic development of the zebrafish. Dev Dyn; 203: 253-310. doi: 10.1002/aja.1002030302
- Kithcart A., MacRae C.A., 2017. Using Zebrafish for High-Throughput Screening of Novel Cardiovascular Drugs. JACC Basic Transl Sci; 2: 1-12. doi: 10.1016/j.jacbts.2017.01.004
- Kohale K., 2021. The Housing and Husbandry of Zebrafish (Danio rerio) in a Laboratory Environment. In: Nagarajan P, Gudde R, Srinivasan R, editors. Essentials of Laboratory Animal Science: Principles and Practices. Springer Singapore, Singapore, pp. 277-311. doi: 10.1007/978-981-16-0987-9_13
- Lange M., Granados A., VijayKumar S., Bragantini J., Ancheta S., Kim Y.-J., et al., 2024. A multimodal zebrafish developmental atlas reveals the state-transition dynamics of late-vertebrate pluripotent axial progenitors. Cell; 187: 6742-6759.e17. doi: 10.1016/j.cell.2024.09.047
- MacRae C.A., Peterson R.T., 2015. Zebrafish as tools for drug discovery. Nature Reviews Drug Discovery; 14: 721-731. doi: 10.1038/nrd4627
- Mendes R.V., Ribeiro J.M., Gouveia H., Rebelo de Almeida C., Castillo-Martin M., Brito M.J., et al., 2025. Zebrafish Avatar testing preclinical study predicts chemotherapy response in breast cancer. npj Precision Oncology; 9: 94. doi: 10.1038/s41698-025-00882-0
- Otterstrom J.J., Lubin A., Payne E.M., Paran Y., 2022. Technologies bringing young Zebrafish from a niche field to the limelight. SLAS Technology; 27: 109-120. doi: https://doi.org/10.1016/j.slast.2021.12.005
- Razali K., Othman N., Mohd Nasir M.H., Doolaanea A.A., Kumar J., Ibrahim W.N., et al., 2021. The Promise of the Zebrafish Model for Parkinson’s Disease: Today’s Science and Tomorrow’s Treatment. Front Genet; 12: 655550. doi: 10.3389/fgene.2021.655550
- Renshaw S.A., Loynes C.A., Trushell D.M., Elworthy S., Ingham P.W., Whyte M.K., 2006. A transgenic zebrafish model of neutrophilic inflammation. Blood; 108: 3976-8. doi: 10.1182/blood-2006-05-024075
- Ruzicka L., Howe D.G., Ramachandran S., Toro S., Van Slyke C.E., Bradford Y.M., et al., 2018. The Zebrafish Information Network: new support for non-coding genes, richer Gene Ontology annotations and the Alliance of Genome Resources. Nucleic Acids Research; 47: D867-D873. doi: 10.1093/nar/gky1090
- Sehnert A.J., Huq A., Weinstein B.M., Walker C., Fishman M., Stainier D.Y., 2002. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nat. Genet.; 31: 106-10. doi: 10.1038/ng875
- Strähle U., Scholz S., Geisler R., Greiner P., Hollert H., Rastegar S., et al., 2012. Zebrafish embryos as an alternative to animal experiments—A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reprod. Toxicol.; 33: 128-132. doi: 10.1016/j.reprotox.2011.06.121
- Streisinger G., Walker C., Dower N., Knauber D., Singer F., 1981. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature; 291: 293-296. doi: 10.1038/291293a0
- Tao R., Qu J., Zhao J., Wu B., Xu H., Yang L., et al., 2025. Zebrafish models in glioma research: advances in methodologies, mechanistic insights, and therapeutic frontiers. Front. Immunol.; Volume 16 – 2025. doi: 10.3389/fimmu.2025.1601656
- Tayanloo-Beik A., Hamidpour S.K., Abedi M., Shojaei H., Tavirani M.R., Namazi N., et al., 2022. Zebrafish Modeling of Autism Spectrum Disorders, Current Status and Future Prospective. Frontiers in Psychiatry; Volume 13 – 2022. doi: 10.3389/fpsyt.2022.911770
- Widder M., Carbaugh C., van der Schalie W., Miller R., Brennan L., Moore A., et al., 2024. Identification of Potential Sepsis Therapeutic Drugs Using a Zebrafish Rapid Screening Approach. Life; 14: 1689.

Monica Torres Ruiz
Doctora en Biología. Investigadora del Instituto de Salud Carlos III

Cortesía de Muy Interesante
Dejanos un comentario:
