En las profundidades del intestino humano o enterradas en sedimentos sin aire, algunas bacterias han encontrado una manera sorprendente de sobrevivir: expulsan electrones como si “respiraran” electricidad. No es una metáfora. Literalmente, estas bacterias transfieren electrones a su entorno como parte de su metabolismo, algo parecido a lo que hace una pila al generar corriente.
Este tipo de “respiración eléctrica” había sido observado en algunos microbios especializados, pero un nuevo estudio publicado en Cell demuestra que Escherichia coli, una bacteria común en biotecnología y en el cuerpo humano, también puede hacerlo. El hallazgo cambia por completo la visión sobre cómo pueden funcionar los metabolismos bacterianos en ausencia de oxígeno. Y lo más fascinante: esta forma de generar energía se basa en una molécula llamada HNQ (2-hidroxi-1,4-naftoquinona), que actúa como un pequeño mensajero eléctrico dentro de la célula.
Una forma de respirar sin aire
La respiración celular clásica que conocemos necesita oxígeno. El oxígeno actúa como receptor final de electrones en una cadena de reacciones que libera energía. Pero en lugares donde no hay oxígeno, las bacterias han desarrollado otros modos para cerrar ese ciclo vital.
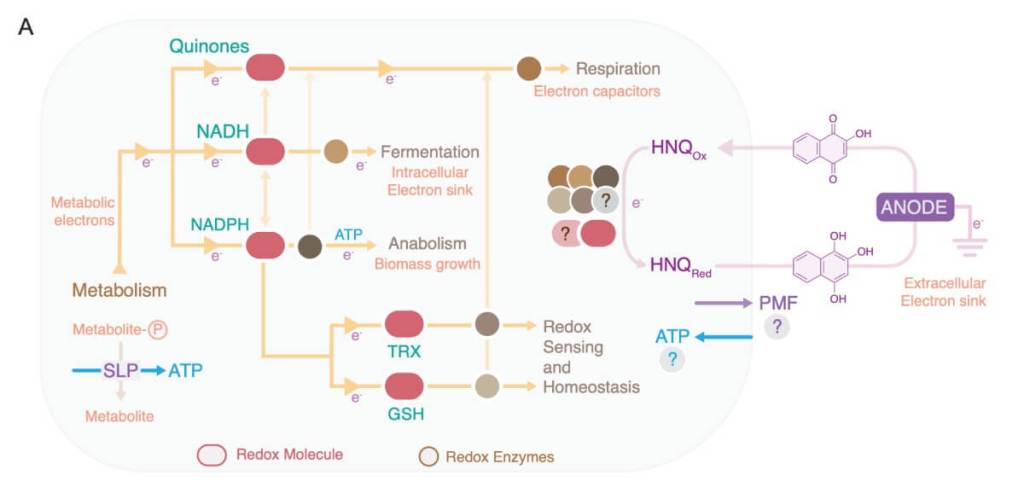
Lo que han descubierto ahora es que ciertas cepas de E. coli pueden deshacerse de sus electrones sobrantes expulsándolos al exterior a través de un circuito eléctrico. Para ello, usan la molécula HNQ como intermediaria. El proceso es conocido como transferencia extracelular de electrones (EET, por sus siglas en inglés).
En el laboratorio, los investigadores colocaron bacterias sobre superficies conductoras y observaron cómo comenzaban a generar corriente eléctrica. Según explican, el fenómeno ocurre cuando la bacteria oxida una fuente de carbono como el glicerol o el piruvato, y usa la HNQ para transferir los electrones hasta el exterior, donde un electrodo los recoge.
El papel clave del NADH y la enzima NfsB
Los resultados mostraron que la principal fuente de electrones en este proceso es el NADH, una molécula crucial en el metabolismo energético. Para saber con certeza quién era el “responsable” de pasar los electrones a la HNQ, el equipo usó una serie de bacterias modificadas genéticamente, eliminando rutas metabólicas una por una.
“La redoxciclación de la HNQ mediante una nitroreductasa citoplasmática permite que E. coli respire y crezca sobre un electrodo extracelular”, escriben los autores del estudio. La enzima clave en esta reacción es NfsB, una nitroreductasa capaz de reducir la HNQ usando NADH.
Cuando las bacterias carecían de NfsB, el proceso casi desaparecía. Y cuando se añadía de nuevo en forma de plásmido, la capacidad para “respirar electricidad” se restauraba. Esto confirma que la NfsB es el motor enzimático de esta nueva vía metabólica.
Energía sin fermentación: una alternativa más eficiente
El estudio va más allá del fenómeno: también evalúa qué tan eficiente es este metabolismo respecto al fermentativo, que es el típico en ausencia de oxígeno. Los autores utilizaron modelos computacionales de metabolismo a gran escala y comprobaron que esta respiración eléctrica ofrece ventajas energéticas claras.
Con fermentación, las bacterias deben convertir glucosa en productos como etanol o lactato para regenerar NAD⁺. Pero eso implica un coste energético y acumulación de compuestos que pueden inhibir el crecimiento. En cambio, con la vía descubierta, se obtiene más ATP gracias a que el proceso libera acetato, y no requiere todos los enzimas de la fermentación.
Simulaciones con modelos ME (Metabolism and Expression) también mostraron que esta vía demanda menos proteínas de estrés y menos recursos globales de la célula. “El análisis sugiere que el metabolismo anaeróbico mediado por HNQ puede no solo rescatar el crecimiento en cepas sin fermentación, sino incluso ofrecer una ruta más eficiente”, concluyen.
Uno de los momentos más llamativos del estudio se produjo cuando una cepa incapaz de crecer anaeróbicamente (FermNull) fue colocada en un entorno sin oxígeno y con HNQ. Al principio no mostraba crecimiento, pero al cabo de unas 40 horas comenzó a producir corriente y a multiplicarse.
Tras esa adaptación, la cepa—rebautizada como FN0—se comportó como una bacteria especializada en “respirar electricidad”. Al ser reintroducida en un sistema electroquímico, generó una corriente 55 veces superior a la cepa sin adaptación. Además, consumía más glucosa y crecía más rápido.
El análisis genético reveló un único cambio en el gen ompC, implicado en el transporte de sustancias a través de la membrana. Es probable que esta mutación facilitara la transferencia de electrones al exterior. También se observaron cambios en genes asociados al metabolismo de aminoácidos y al ciclo de Krebs, lo que sugiere una reprogramación metabólica para adaptarse a esta nueva forma de respiración.
¿Para qué sirve “respirar” electricidad?
Más allá de la sorpresa biológica, el hallazgo tiene aplicaciones prácticas. Según los autores, este tipo de metabolismo podría utilizarse en sensores bioelectrónicos, tratamiento de aguas residuales o procesos de biorremediación. También podría facilitar nuevas formas de captura de carbono, usando bacterias que conviertan CO₂ en materia útil con ayuda de una corriente eléctrica.
“Nuestro trabajo sienta las bases para capturar dióxido de carbono mediante electricidad renovable, con bacterias que funcionan de manera similar a las plantas en la fotosíntesis”, explican en el estudio. También sugieren que se podrían diseñar sistemas bacterianos capaces de generar señales eléctricas ante contaminantes, permitiendo una monitorización ambiental en tiempo real.
Además, este metabolismo tiene interés para misiones espaciales, donde la producción de energía en condiciones sin oxígeno es crítica. Las bacterias que respiran electricidad podrían ayudar a crear sistemas autosuficientes en ambientes extremos.
Una estrategia microbiana común… pero oculta
Hasta ahora, se pensaba que E. coli no era capaz de realizar EET de forma natural, y que sólo se podía forzar con ingeniería genética. Sin embargo, este estudio demuestra que es una capacidad latente, que puede activarse si se dan las condiciones adecuadas, como la presencia de HNQ y un electrodo.
El trabajo también plantea que otros microbios podrían tener esta misma capacidad escondida, esperando condiciones específicas para activarla. Algunas especies ya conocidas, como Shewanella o Geobacter, usan estrategias similares. Pero E. coli es un organismo modelo y muy usado en biotecnología, por lo que el descubrimiento tiene un gran potencial.
Desde el punto de vista ecológico, esto abre la posibilidad de que muchas bacterias en el intestino humano, en suelos o en ambientes anóxicos, estén usando compuestos naturales como la HNQ para sobrevivir mediante una forma de respiración hasta ahora inadvertida.
Referencias
- Biki Bapi Kundu, Jayanth Krishnan, Richard Szubin, Arjun Patel, Bernhard O. Palsson, Daniel C. Zielinski y Caroline M. Ajo-Franklin. Extracellular respiration is a latent energy metabolism in Escherichia coli. Cell, abril de 2025. DOI: 10.1016/j.cell.2025.03.016.
Cortesía de Muy Interesante
Dejanos un comentario: