Cuando Ellen Ripley y sus compañeros, viajando por el espacio, desembarcan en el planeta Acheron, se exponen por primera vez a una especie que la humanidad jamás había encontrado. Las consecuencias son conocidas: una alienígena coloniza la nave y parasita a los tripulantes para reproducirse. En esa película (Alien, el octavo pasajero), Ripley era adulta, por lo que a lo largo de su vida ya se había enfrentado a una gran diversidad de organismos. Pero, ¿cómo habrá sido su primer encuentro con otros seres vivos? ¿Habrá sido beneficioso o perjudicial? ¿Y en nuestro caso? Para responder a esa pregunta, tendríamos que remontarnos mucho tiempo atrás en nuestra vida… tal vez hasta el momento en que esta comenzó a originarse.
En las primeras etapas del desarrollo, pocos días después de la fecundación, el embrión del que venimos viajó por el tracto reproductor femenino. Para poder implantarse en el útero, necesitó desprenderse de una cubierta protectora, como si fuera un traje espacial, llamada zona pelúcida. Sin esa protección, nuestro embrión quedó expuesto, por primera vez, al entorno uterino. ¿Qué organismos desconocidos podrían encontrarse en el útero? Aunque no se trate de criaturas extraterrestres, muchos microorganismos pueden colonizar ese ambiente. Las infecciones bacterianas uterinas son frecuentes y representan un serio problema médico, que puede requerir tratamiento con antibióticos o incluso intervenciones quirúrgicas, según su gravedad. Esto motivó a mi grupo de investigación a explorar los misterios de ese primer encuentro entre un ser humano en formación y los microorganismos que lo rodean, dando como resultado el artículo que publicamos recientemente.
Los embriones eliminan bacterias patogénicas de su entorno
En esos primeros días de desarrollo, el embrión todavía no ha formado ninguno de sus órganos ni tejidos. Por lo tanto, tampoco posee glóbulos blancos, las células del sistema inmunitario responsables de defendernos frente a infecciones. ¿Estará entonces el embrión completamente indefenso ante la presencia de organismos patogénicos? Para responder esa pregunta, primero debemos entender cómo es exactamente un embrión de pocos días. Está compuesto únicamente por dos tipos de células. Las pluripotentes, también conocidas como células madre, darán origen más adelante a todos los órganos del feto. Pero la superficie del embrión está formada por otro tipo de células, las epiteliales, que cumplen varias funciones, entre ellas permitir la implantación del embrión en el útero (Figura 1).
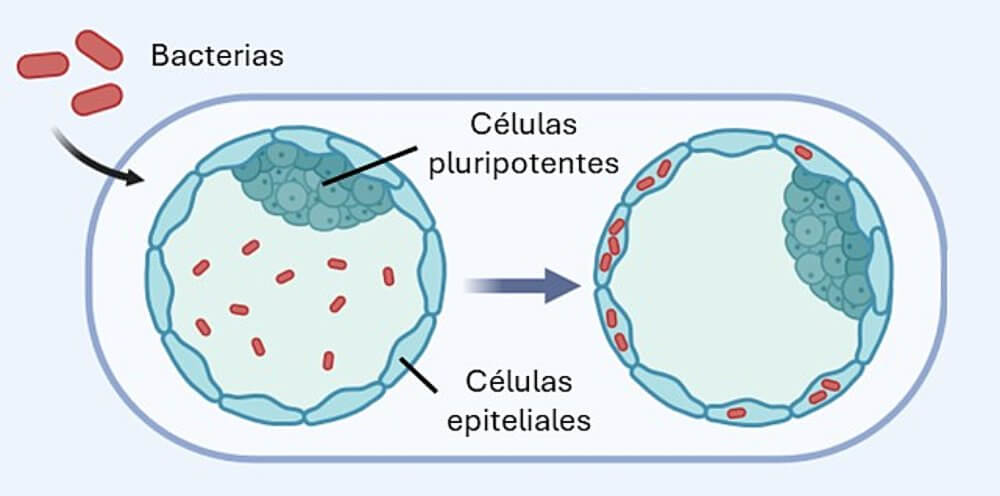
En un trabajo previo de nuestro grupo, habíamos descubierto que estas células epiteliales pueden llevar a cabo un proceso típico de los glóbulos blancos: la fagocitosis. Este mecanismo implica la ingestión y destrucción de objetos potencialmente dañinos para los tejidos, y constituye una de las formas más fundamentales en las que el sistema inmunitario nos protege. Lo que habíamos observado es que estas células superficiales eliminan, mediante fagocitosis, otras células embrionarias que presentan defectos, evitando así que participen en la formación de órganos que podrían desarrollarse con fallas. Una especie de control de calidad de las células que formarán el cuerpo del embrión. Esto nos llevó a una nueva pregunta: ¿Podrían estas células de la superficie utilizar ese mismo mecanismo de fagocitosis para combatir infecciones? ¿Serían capaces de destruir microorganismos nocivos?
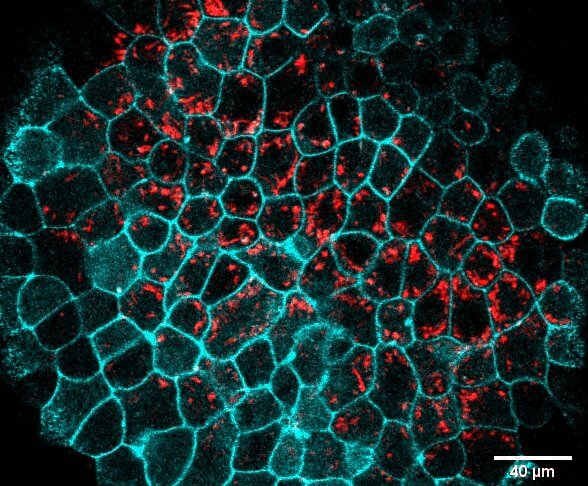
Para evaluar qué sucede cuando el embrión se encuentra con bacterias, Joan Roncero Carol, un investigador predoctoral de mi grupo, comenzó a filmar este proceso utilizando sofisticadas técnicas de microscopía y bacterias fluorescentes. En primer lugar, empleamos un modelo animal: embriones de pez cebra. Este modelo presenta varias ventajas: los embriones se desarrollan fuera del cuerpo de la madre, pueden manipularse y teñirse fácilmente con herramientas genéticas, y, lo más importante, realizan fagocitosis de manera muy similar a los embriones de otras especies. Estas películas nos revelaron que estos embriones son capaces de reconocer, ingerir y destruir distintos tipos de bacterias (Figuras 1 y 2). Es decir, aunque las bacterias logren ingresar en el embrión, como los Aliens lo hacían en los cuerpos de los tripulantes de la nave, en este caso es el embrión quien destruye a las bacterias, evitando que lo “parasiten”.
Inmunidad antes del sistema inmunitario
Estas filmaciones microscópicas también nos permitieron identificar cómo hacen las células epiteliales para eliminar a las bacterias. Vimos que estas células son capaces de deformarse, generando protuberancias que rodean a las bacterias hasta ingerirlas. Una vez dentro, las bacterias son dirigidas hacia una región de la célula donde se desencadenan reacciones químicas que las destruyen. Todo este proceso se acompaña de la activación de un grupo de genes relacionados con la inmunidad, que habitualmente participan en la defensa contra infecciones. Gracias a esta actividad fagocítica de las células epiteliales, los embriones pueden defenderse de infecciones mucho antes de que se formen los glóbulos blancos, representando de esta manera el inicio de la inmunidad.
Embriones humanos combatiendo infecciones: posibles aplicaciones
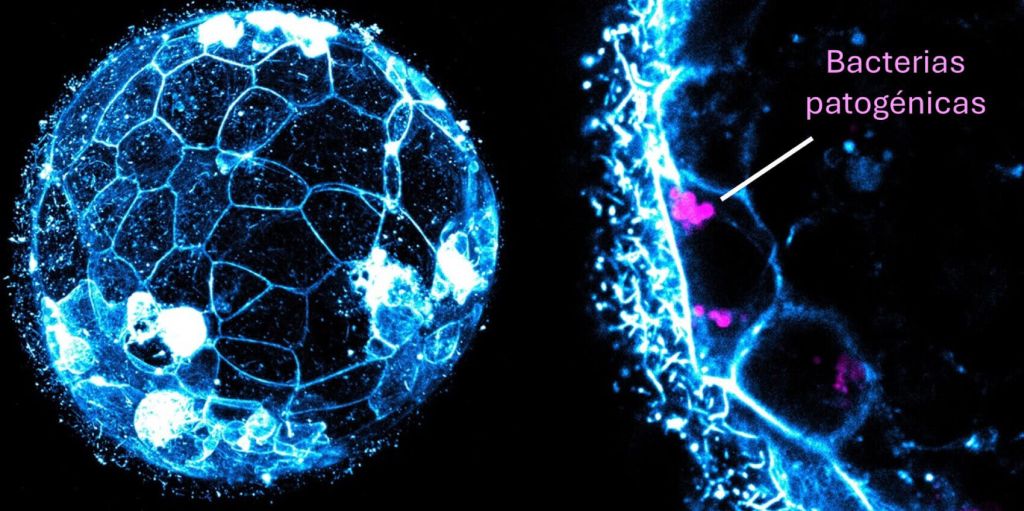
Finalmente, era crucial evaluar directamente si esta defensa también estaba presente en embriones humanos. Para ello realizamos nuevos experimentos, en los que observamos que los embriones humanos eran capaces de fagocitar y destruir bacterias como Staphylococcus aureus, una de las causantes de infecciones en el útero (Figura 3). ¿Implica esto que el embrión es tan eficaz como el sistema inmunitario? Aún no lo sabemos, y es una pregunta experimentalmente difícil de abordar durante el desarrollo natural dentro del útero. Sin embargo, este descubrimiento nos indica que debemos comprender mejor las interacciones entre embriones y bacterias, ya que infecciones asociadas a condiciones como la enfermedad pélvica inflamatoria o la endometritis crónica han sido vinculadas con la infertilidad.
Ahora que sabemos que el embrión interactúa activamente con estos microorganismos, podríamos considerar que, además de afectar la receptividad del útero para la implantación, las bacterias también podrían estar interfiriendo con el desarrollo embrionario en sí mismo. Esta podría ser una nueva causa potencial de infertilidad, lo cual es especialmente relevante si consideramos que aproximadamente el 20 % de los casos de infertilidad son de causa desconocida. Además, una posible capacidad reducida para lidiar con microorganismos podría mediar un desarrollo embrionario anómalo, y quizás explicar ciertos casos de malformaciones. A largo plazo, estos hallazgos podrían contribuir a mejorar el diagnóstico y tratamiento de enfermedades reproductivas.
Un mundo de posibles interacciones microscópicas
Nuestra investigación también nos plantea nuevas preguntas. Dado que el embrión es capaz de defenderse de bacterias patogénicas, ¿es posible que pueda interactuar de manera beneficiosa con bacterias no patogénicas que residan en el útero? Por ejemplo, sabemos que ciertas poblaciones bacterianas del intestino contribuyen al funcionamiento normal de ese órgano. ¿Podrían, entonces, bacterias residentes del útero favorecer el proceso reproductivo? Para poder comprender estos fenómenos, primero debemos determinar con precisión si existen poblaciones estables de bacterias no patogénicas en el útero, un aspecto sobre el cual todavía sabemos muy poco. Estas y otras cuestiones poco estudiadas de la fisiopatología reproductiva femenina requieren una mayor atención e investigación clínica. Si se confirmara la presencia de bacterias no patogénicas en el útero, podríamos incluso especular con la posibilidad de una coevolución cooperativa, simbiótica, entre estas bacterias y la reproducción de su hospedador humano. Y aunque esta forma de interacción parecería más constructiva que la imaginada con las Aliens, en realidad, ellas solo buscaban reproducirse…
Referencias
- Roncero-Carol J., Olaizola-Muñoa J… and Hoijman E. Epithelial cells provide immunocompetence to the early embryo for bacterial clearance. Cell Host & Microbe. (2025). doi: 10.1016/j.chom.2025.05.025
- Hoijman E., Häkkinen HM., Tolosa-Ramon, Q. et al. Cooperative epithelial phagocytosis enables error correction in the early embryo. Nature. (2021). doi: 10.1038/s41586-021-03200-3

Esteban Hoijman
Doctor en Química Biológica. Investigador del CSIC

Cortesía de Muy Interesante
Dejanos un comentario:
