La secuenciación de nueva generación (NGS, por sus siglas en inglés) es una tecnología avanzada que permite leer y analizar de manera rápida y precisa el ADN o ARN, para conocer su secuencia exacta de “letras” (nucleótidos). Esto facilita la detección de mutaciones en los genes, que son fragmentos de ADN que contienen la información necesaria para que el cuerpo produzca proteínas y estas realicen diversas funciones celulares. La NGS ha supuesto una revolución en el diagnóstico genético gracias al análisis masivo y simultáneo de genes, permitiendo identificar mutaciones asociadas a enfermedades hereditarias, cáncer y otras patologías.
Según los requerimientos diagnósticos o de investigación, se pueden emplear distintas opciones de NGS: secuenciación con paneles de genes, secuenciación del exoma (WES) o secuenciación del genoma completo (WGS).
Los paneles de genes son ideales para el diagnóstico de enfermedades hereditarias bien caracterizadas, es decir, en las que se conocen los genes que están asociados a ellas. La secuenciación de exomas y genomas completos facilitan el diagnóstico de trastornos cuya causa genética es desconocida. En concreto, la secuenciación del exomaanaliza las regiones codificantes del ADN (exones), donde ocurren la mayoría de las mutaciones con impacto clínico, y la secuenciación del genoma completo examina el ADN en su totalidad, incluyendo también las regiones no codificantes (intrones). La elección entre estas opciones depende de si se conoce la causa genética y de la disponibilidad de recursos para el diagnóstico o la investigación de una enfermedad (1).
Impacto de la NGS
La secuenciación de nueva generación (NGS) es una tecnología innovadora que ha revolucionado la genética y la biomedicina, con aplicaciones fundamentales en diversas áreas. Su rapidez en la obtención de resultados en comparación con los métodos tradicionales facilita su uso tanto en la investigación como en la práctica clínica. Además, su alta sensibilidad y capacidad de detección han permitido grandes avances en el diagnóstico de enfermedades genéticas, al identificar mutaciones responsables de trastornos hereditarios, síndromes poco frecuentes y enfermedades complejas.
En medicina de precisión, ayuda a personalizar tratamientos según la genética de los pacientes, mejorando la eficacia y reduciendo efectos adversos, especialmente en oncología, donde permite terapias dirigidas (2).
En el diagnóstico del cáncer, facilita la detección de ADN tumoral circulante mediante biopsia líquida, permitiendo diagnósticos menos invasivos (3). Al mismo tiempo, ha mejorado el diagnóstico de enfermedades raras y complejas, identificando mutaciones mediante el análisis del exoma o genoma que previamente eran indetectables con métodos tradicionales.
En genética prenatal, se usa para detectar anomalías cromosómicas fetales y para la selección embrionaria en tratamientos de fertilidad. También juega un papel crucial en terapia génica, permitiendo identificar mutaciones para desarrollar tratamientos que corrijan o reemplacen genes defectuosos.
En biología del desarrollo, proporciona información sobre la regulación génica y cómo los errores en este proceso pueden conducir a malformaciones o trastornos de desarrollo. En transcriptómica (secuenciación de ARN) permite estudiar la expresión génica en diferentes condiciones, lo que es fundamental para comprender enfermedades complejas.
Su utilización también ha impulsado avances en biología computacional, ya que se han mejorado los algoritmos para analizar los grandes volúmenes de datos genómicos que se generan con su uso, principalmente con el estudio de genomas y exomas completos.
Paneles de genes en diagnóstico
En la actualidad existen paneles de genes para el diagnóstico de múltiples enfermedades como la fibrosis quística, enfermedades metabólicas, distrofias musculares y cáncer, entre otras. En concreto, en oncología han sido desarrollados para el diagnóstico de cáncer de mama, ovario, colorrectal y otros tumores con predisposición genética, como es el caso del cáncer ocular denominado retinoblastoma. Este último es una enfermedad de origen genético bien caracterizada, donde las mutaciones responsables de la patología ocurren en el gen RB1, por lo que es un buen candidato para diseñar un panel que abarque el gen completo y avanzar en el diagnóstico de la enfermedad.
Descubriendo el Retinoblastoma: un cáncer ocular infantil
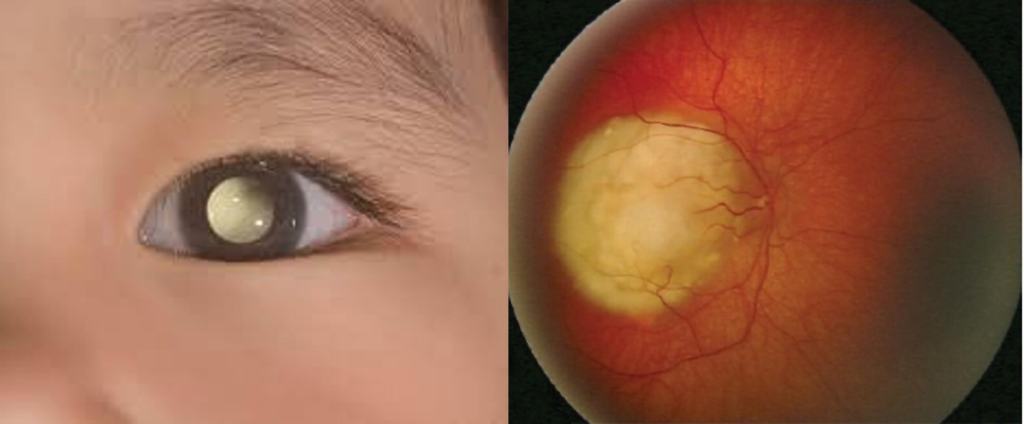
El retinoblastoma es un tumor ocular poco frecuente, que afecta a niños/as menores de cinco años, representando el 5% de las causas de ceguera infantil. Aunque es poco frecuente, su diagnóstico temprano es crucial para mejorar las tasas de supervivencia y minimizar los efectos a largo plazo, como son los problemas de visión y el riesgo de desarrollar otros tumores en la edad adulta. Existen dos formas de presentación: unilateral, afectando a un solo ojo, y bilateral, afectando a ambos. La edad media de diagnóstico en los casos bilaterales es de 12 meses y en los unilaterales de 23 meses. Con un tratamiento adecuado, la tasa de supervivencia a los cinco años supera el 90%. La detección temprana y la administración de un tratamiento apropiado son esenciales para reducir las secuelas de la enfermedad.
Diagnóstico clínico, opciones de tratamiento e incidencia
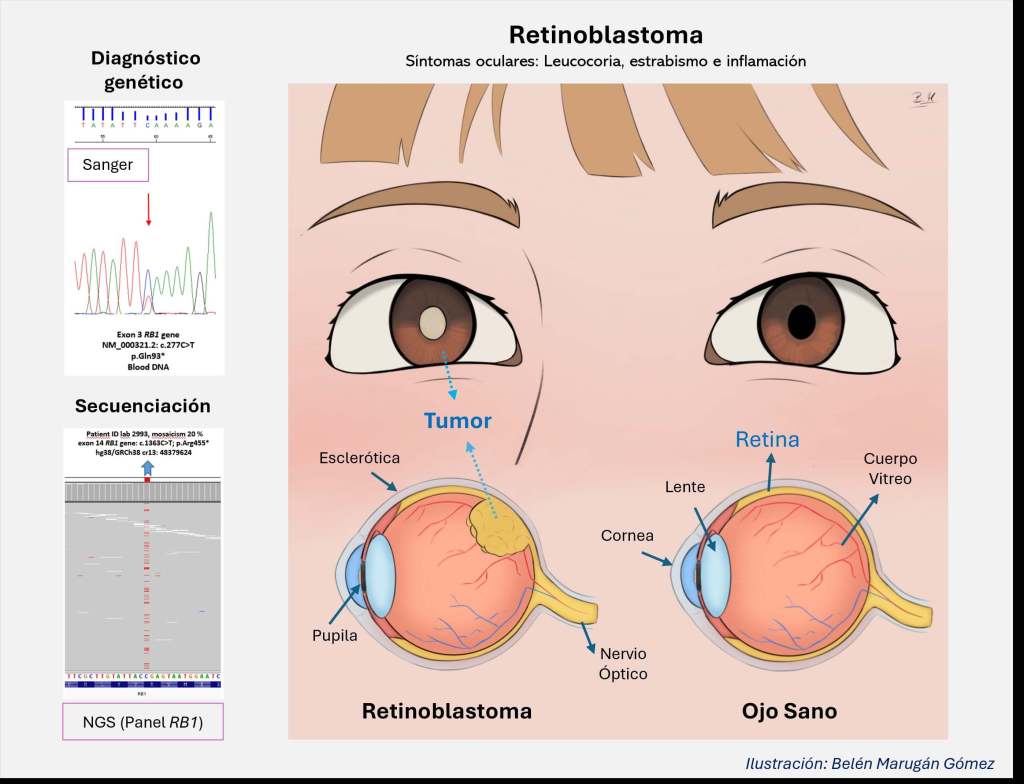
El diagnóstico clínico de retinoblastoma se realiza combinando la historia clínica con un examen ocular detallado que suele incluir: ecografía ocular, tomografía computarizada (TAC) y resonancia magnética (RM). La detección temprana de los síntomas es clave para aplicar el tratamiento y así frenar su evolución. El síntoma más común es la leucocoria, un reflejo blanco en la pupila que se nota especialmente en fotografías con flash. Otros síntomas son: estrabismo, inflamación ocular, glaucoma y celulitis orbitaria, caracterizada por hinchazón severa de los párpados y dificultad en los movimientos oculares. La combinación de estos hallazgos orienta al diagnóstico clínico y permite iniciar el tratamiento adecuado lo antes posible (4 y 5). Imagen 1.
El tratamiento de los pacientes con retinoblastoma está basado en quimioterapia, radioterapia y crioterapia. En los casos más avanzados o cuando los tratamientos anteriores no son efectivos, es necesaria la enucleación, que consiste en la extracción del globo ocular.
A nivel mundial, la incidencia de retinoblastoma se estima en 1 de cada 15.000 a 18.000 nacimientos (6). En España, se diagnostican entre 20 y 30 casos nuevos de retinoblastoma al año, lo que equivale al 3% de todos los cánceres en menores de 14 años.
Bases genéticas de la enfermedad
La hipótesis de Knudson (1971), también conocida como la teoría de las dos mutaciones, describe cómo se desarrollan ciertos tipos de cáncer, en particular el retinoblastoma. Según esta teoría, dado que cada individuo tiene dos copias de cada gen, ambas deben mutar para que se desarrolle la enfermedad. El retinoblastoma es causado por mutaciones en el gen RB1, ubicado en el cromosoma 13. Este gen es el primer gen supresor de tumores descrito, cuya función principal es regular el crecimiento celular y prevenir la formación de tumores. Cuando este gen funciona correctamente, ayuda a evitar que las células crezcan de manera descontrolada y den lugar a la aparición de tumores. Sin embargo, si presenta alteraciones (mutaciones) pierde su capacidad de controlar la división celular y contribuye al desarrollo tumoral, en este caso retinoblastoma.
Puede presentarse tanto como enfermedad hereditaria (40%) o esporádica (60%). Los pacientes con retinoblastoma hereditario corren el riesgo de desarrollar segundos tumores en la edad adulta, principalmente osteosarcomas, que son más agresivos y tienen peor pronóstico que el retinoblastoma. Por ello, la detección de mutaciones en el gen RB1es de vital importancia para llevar a cabo el seguimiento de estos pacientes (7).
Panel de genes: herramienta clave para el diagnóstico de Retinoblastoma
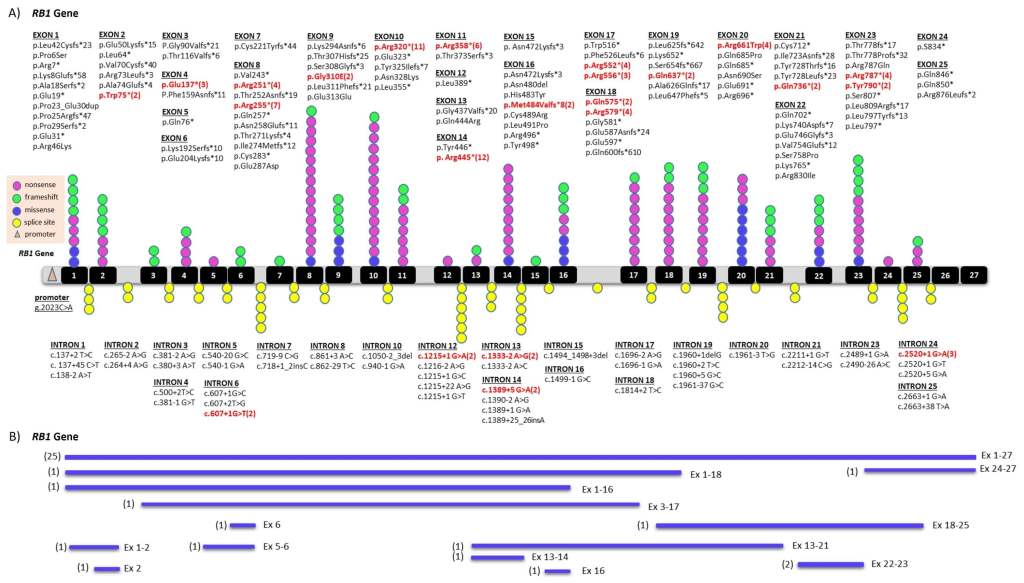
Un estudio reciente realizado en el Instituto de Investigación de Enfermedades Raras (IIER) del Instituto de Salud Carlos III (ISCIII), publicado en la revista Experimental Eye Research, ha analizado la distribución y frecuencia de diferentes mutaciones en una cohorte de 579 pacientes españoles con retinoblastoma (353 unilaterales y 226 bilaterales) (8). Imagen 2.
La investigación incluyó dos tipos de análisis genéticos: el primero con técnicas convencionales como la secuenciación Sanger y el MLPA (Imagen 3), y el segundo, con el uso de un panel de genes (panel RB1-NGS). Mediante las técnicas convencionales se detectaron mutaciones en el gen RB1 esponsables de la enfermedad en 263 pacientes (45.5% de éxito en el diagnóstico). No obstante, la utilización de un panel de genes RB1-NGS aumentó el número de pacientes diagnosticados. Se identificaron mutaciones en mosaicismo gracias a la sensibilidad de la técnica NGS y mutaciones en regiones intrónicas del gen RB1 gracias a que se estudia el gen completo.
Las mutaciones en mosaicismo son aquellas que están presentes en una proporción reducida de células dentro de un individuo, es decir, no afectan a todas las células del organismo. Debido a su baja frecuencia, es fundamental el uso de técnicas altamente sensibles para su detección (9). La incorporación del análisis con el panel de genes RB1-NGS en el diagnóstico de los pacientes españoles, ha mejorado significativamente la detección de estas mutaciones estando presentes en el 10% de los casos estudiados, en particular en casos esporádicos donde la tasa de identificación suele ser menor.
Las mutaciones en regiones intrónicas del gen RB1 se encuentran en áreas del genoma que no eran analizadas con técnicas convencionales debido a que son regiones que se corresponden con fragmentos extensos de ADN que no codifican proteínas, es decir, no contienen instrucciones involucradas en funciones celulares. Se ha detectado este tipo de mutaciones en el 7.1% de los pacientes españoles diagnosticados con retinoblastoma, indicando su implicación en la enfermedad.
En resumen, los autores del estudio resaltan que estos hallazgos ponen de manifiesto el potencial de las técnicas NGS para detectar alteraciones genéticas que pasaban desapercibidas con métodos convencionales, lo que mejora significativamente la precisión diagnóstica. Por ello, la integración de la secuenciación genómica de nueva generación en el diagnóstico de retinoblastoma no solo optimiza la detección de la enfermedad, sino también su manejo clínico.
Relevancia del diagnóstico de Retinoblastoma mediante NGS
El papel de la Secuenciación de Nueva Generación (NGS) en el diagnóstico del Retinoblastoma ha mejorado significativamente la detección de mutaciones en el gen de RB1, facilitando un diagnóstico más preciso y temprano, así como poder ofrecer un consejo genético a las familias. En los casos hereditarios, la identificación de mutaciones en el gen RB1 es esencial para establecer medidas preventivas en familiares con riesgo de desarrollar la enfermedad. Asimismo, gracias a su sensibilidad, también ofrece mejoras en el diagnóstico prenatal en familias con antecedentes de retinoblastoma.
La detección temprana de la enfermedad tiene implicaciones directas en la mejora del pronóstico, permitiendo enfoques terapéuticos más personalizados (10). Igualmente, ha proporcionado herramientas para el diagnóstico de la enfermedad a partir de biopsias líquidas, analizando ADN tumoral en sangre o en el humor acuoso del ojo, evitando así procedimientos invasivos. Por tanto, el uso de técnicas NGS en el diagnóstico de estos pacientes, no solo reduce la necesidad de pruebas invasivas, sino que también puede contribuir a la preservación de la visión en algunos casos.
El desarrollo de la NGS en oncología pediátrica sigue avanzando, abriendo nuevas posibilidades para mejorar el diagnóstico, la personalización del tratamiento y la prevención de este tipo de cáncer ocular.
Desafíos y futuro de la NGS
A pesar de sus enormes ventajas, la implementación de la NGS en la práctica clínica aún se enfrenta a desafíos como son la interpretación de los datos obtenidos de genomas, exomas y transcriptomas, la regulación de su uso y el acceso equitativo a esta tecnología. Sin embargo, con el avance continuo en bioinformática para el procesamiento de datos genómicos, y la reducción de costes, se espera que la secuenciación de nueva generación transforme aún más el diagnóstico médico y la prevención de enfermedades en los próximos años. La secuenciación de nueva generación (NGS) seguirá participando de los avances en medicina e investigación, con un impacto relevante en el diagnóstico y tratamiento de enfermedades.
Referencias
- (1). Mardis, E. R. et al. (2008). Next-generation DNA sequencing methods. Annual Review of Genomics and Human Genetics, 9, 387-402. https://doi.org/10.1146/annurev.genom.9.081307.164359
- (2). Salzberg, S. L. et al. (2017). Next-generation genome sequencing and the future of medicine. Genome Biology, 18(1), 29. https://doi.org/10.1186/s13059-017-1165-2.
- (3). Pereira, C. A., et al. (2020). Next-Generation Sequencing Applications in Cancer Diagnosis and Therapy. Molecular Cancer Research, 18 (10), 1391-1399. https://doi.org/10.1158/1541-7786.MCR-20-0134
- (4) “Tratamiento del retinoblastoma (PDQ®)”– publicado por el Instituto Nacional del Cáncer. Tratamiento del retinoblastoma
- (5). Kaliki S, et al. (2015). Retinoblastoma: achieving new standards with methods of chemotherapy. Indian J Ophthalmol.;63(2):103-109. doi:10.4103/0301-4738.154369
- (6). Jaume Català Mora et al. (2023). Capítulo libro 5.6 https://www.oftalmoseo.com/documentacion/P2023/P2023_capitulo-5.6.pdf?utm_source=chatgpt.com
- (7) Fujiwara, T et al. (2015). Second primary osteosarcomas in patients with retinoblastoma. Jpn. J. Clin. Oncol. 45, 1139–1145. https://doi.org/10.1093/jjco/hyv140
- (8) Gomez-Mariano, G et al. (2025). Mosaicism and intronic variants in RB1 gene revealed by next generation sequencing in a cohort of Spanish retinoblastoma patients. Experimental Eye Research, Volume 251, 2025, 110233, ISSN 0014-4835. https://doi.org/10.1016/j.exer.2025.110233
- (9). Amitrano, S. et al. (2015). Next generation sequencing in sporadic retinoblastoma patients reveals somatic mosaicism. Eur. J. Hum. Genet. EJHG 23, 1523–1530. https://doi.org/10.1038/ejhg.2015.6
- (10) Li, W.L., et al. (2016). A Rapid and Sensitive Next-Generation Sequencing Method to Detect RB1 Mutations Improves Care for Retinoblastoma Patients and Their Families. J. Mol. Diagn. JMD 18, 480–493. https://doi.org/10.1016/j.jmoldx.2016.02.006

Gema Gómez-Mariano
Doctora en Biología por la Universidad Autónoma de Madrid. Científica Titular del ISCIII.


Esther Hernández-SanMiguel
Doctora en “Biotecnología: Aplicaciones Biomédicas” por la Universidad de Valladolid (2008)


Marta Fernández-Prieto
Doctora en Biociencias: Biología y Clínica del Cáncer y Medicina Traslacional

Cortesía de Muy Interesante
Dejanos un comentario:
