Una cerveza caliente en verano es una especie de tragedia estacional. Pero lo fascinante es que la solución no depende de tecnología sofisticada, sino de principios físicos tan básicos como poderosos. Basta con hielo, agua, sal… y un poco de ciencia. En este artículo vamos a explicar, desde un enfoque riguroso pero accesible, por qué ese botellín alcanza la temperatura ideal en pocos minutos. La clave está en un cambio de fase y en un gráfico muy simple.
Este tema ya fue abordado en un artículo anterior, donde se explicaba paso a paso cómo enfriar una cerveza rápidamente usando hielo, agua y sal, y se ofrecían instrucciones prácticas para aplicarlo en situaciones cotidianas. Sin embargo, el objetivo aquí no es repetir ese contenido, sino ir un paso más allá: entender con más precisión por qué funciona. Vamos a centrarnos en el mecanismo físico que lo hace posible —el cambio de fase y la transferencia de calor— y en cómo una sencilla representación gráfica puede ayudarnos a visualizar todo el proceso de forma clara y directa.
La física detrás de un botellín frío: en realidad se “calienta” el hielo
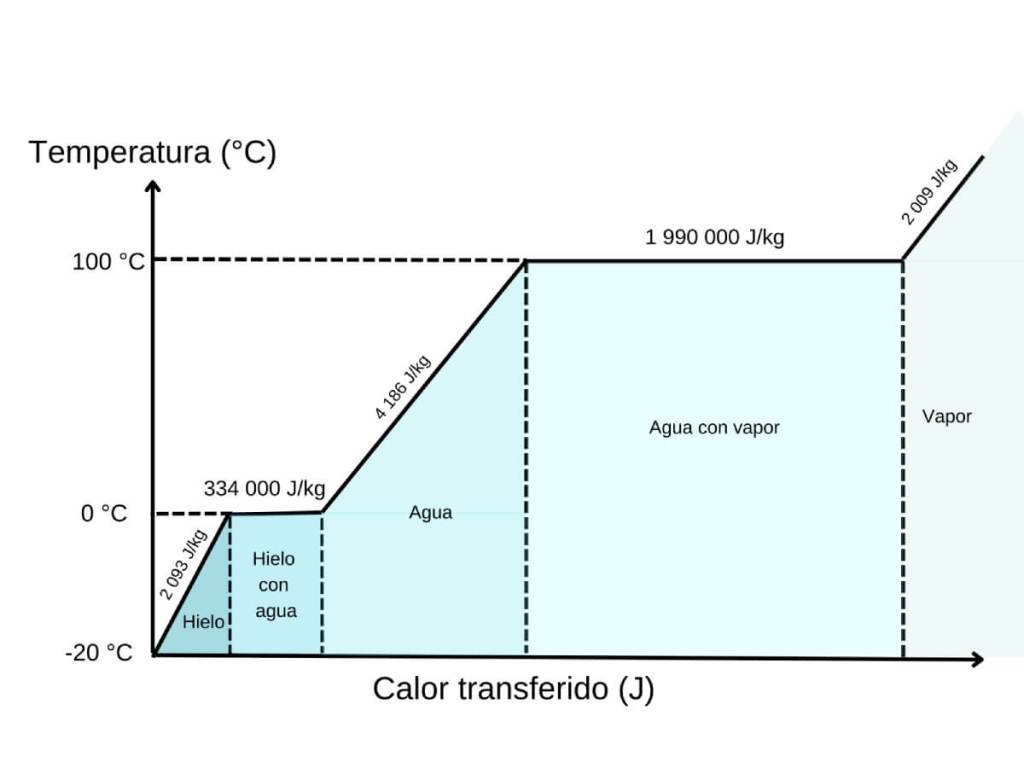
Cuando introducimos una botella a temperatura ambiente en una mezcla de agua, hielo y sal, se activa un mecanismo de transferencia de energía muy eficiente. El protagonista es el hielo, que al fundirse necesita absorber calor: es lo que se conoce como calor latente de fusión. Lo interesante es que durante ese proceso, la temperatura del hielo no aumenta. Toda la energía absorbida se invierte exclusivamente en romper las estructuras cristalinas del hielo para convertirlo en agua líquida.
Ese calor necesario para derretir el hielo no aparece de la nada. Proviene del entorno inmediato, es decir, del agua que lo rodea y de las botellas de cerveza. En la práctica, el hielo “roba” calor a la cerveza, lo que provoca una rápida disminución de su temperatura.
El papel de la sal: manipular el punto de congelación
Añadir sal a la mezcla altera un segundo fenómeno físico fundamental: el descenso crioscópico. Al incorporar sal, el punto de congelación del agua desciende por debajo de los 0 °C. Esto obliga al sistema a alcanzar temperaturas más bajas antes de que el hielo pueda dejar de fundirse. En algunos casos, la mezcla puede estabilizarse en torno a los –10 °C.
Esto amplifica la diferencia de temperatura entre la cerveza y el medio en el que está sumergida, haciendo que el calor fluya aún más deprisa desde el interior del botellín hacia el exterior.

Una gráfica (cualitativa) que lo explica todo
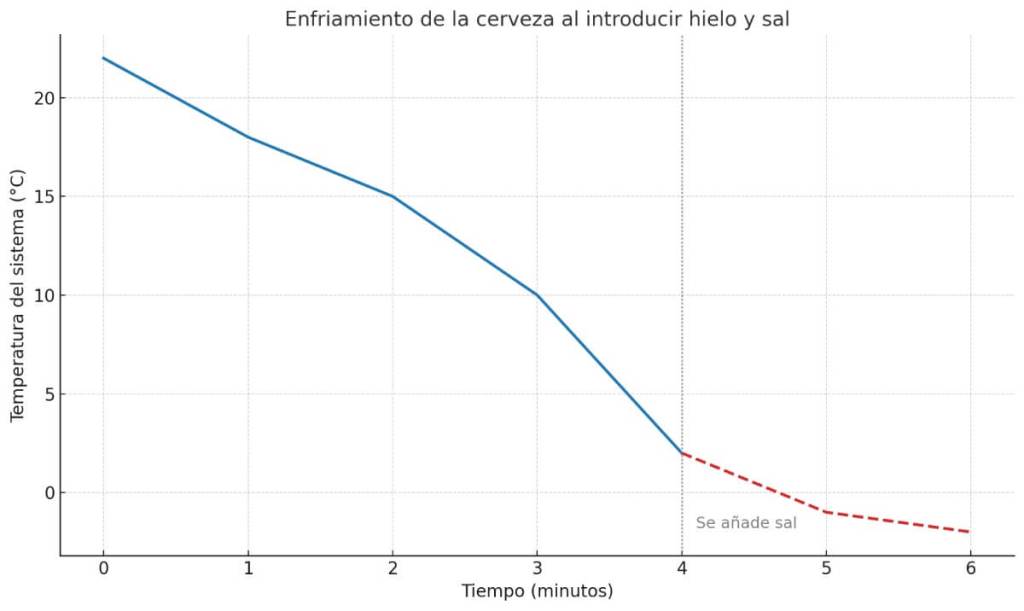
Si representáramos la temperatura del sistema en función del tiempo, observaríamos una primera caída moderada al introducir el hielo en agua. Pero al añadir sal, el enfriamiento continúa por debajo de 0 ºC, contrario a lo que nos dice la intuición. La gráfica mostraría cómo se pasa de un enfriamiento progresivo que parece que se va a detener en 0 ªC a un enfriamiento continuado, justo en el momento en que el sistema entra en el rango de temperaturas bajo cero.
Este cambio de pendiente refleja la eficiencia térmica del sistema: a mayor gradiente de temperatura entre la cerveza y su entorno, mayor velocidad de transferencia de calor. Y si el entorno está por debajo del punto de congelación del agua, el efecto es aún más contundente.
El agua como conductor térmico
Otro factor crucial en el proceso es el agua. Aunque puede parecer que enfría menos que el hielo, su presencia es indispensable. Al ser un líquido, el agua se adapta perfectamente a la forma de las botellas, rellenando todos los huecos. Esto asegura un contacto constante y uniforme entre el medio frío y la superficie de la botella, lo que maximiza la transferencia de calor por conducción.
Este efecto se potencia aún más si se utiliza hielo picado, ya que su mayor superficie de contacto permite una transferencia térmica más eficiente. Cada pequeño trozo de hielo actúa como un canal de absorción de calor, mucho más eficaz que los cubos grandes, que dejan espacios vacíos entre las botellas.
Entonces… ¿cuál es la curva?: ¡la meseta del frío!
Es la que representa cómo el hielo, al recibir calor, no cambia de temperatura al instante, sino que se queda en 0 °C mientras se derrite. Esa línea horizontal, esa pausa en la caída de la temperatura, es la clave: aunque el entorno siga enfriando, el hielo necesita absorber energía para romper su estructura sólida y convertirse en agua. La curva no muestra solo un descenso: muestra una transformación. Y en esa meseta está el corazón del proceso.
Cortesía de Muy Interesante
Dejanos un comentario: