Fuente de la imagen, © Agustina Galain
- Autor, Alejandra Martins
- Título del autor, Redacción
- Informa desde BBC News Mundo
“Fue maravilloso. Teníamos todo preparado a nivel de desarrollo técnico para comenzar a hacer este tipo de tratamientos en Uruguay. Y un día recibimos el llamado de un médico”.
El científico Gregorio Iraola es el CEO de Kinzbio, una empresa de biotecnología uruguaya que logró crear en tiempo récord medicamentos personalizados con “virus buenos” que atacan bacterias, los llamados bacteriófagos o fagos.
Con ellos se trató exitosamente a pacientes con graves infecciones resistentes a antibióticos.
El primer paciente fue tratado en mayo y su médico -que ya estaba al tanto de las investigaciones de Iraola y contactó al científico- fue el doctor Fabio Grill.
“El paciente tras una internación prolongada hospitalaria (Unidad de Cuidados Intensivos incluida) padeció múltiples episodios de infección pulmonar por un mismo microorganismo que era resistente a la mayoría de los antibióticos habituales”, le dice a BBC Mundo Grill, médico infectólogo e intensivista del centro médico CASMU-IAMPP en Montevideo.
“Visto que no era posible erradicar la bacteria, tras una evaluación de alternativas posibles se planteó que la terapia de bacteriófagos podría ser una alternativa”.
“El resultado superó las expectativas. Se realizó un ciclo de fagos específico frente a la bacteria a través de nebulizaciones. Se hizo un seguimiento clínico-microbiológico, destacando la ausencia de efectos secundarios, incluidos los que se puede esperar en tratamientos inhalatorios, como broncoespasmo”, agrega.
“Tras el tratamiento, no se volvió a repetir ninguna sintomatología infecciosa respiratoria, ni cultivos respiratorios positivos, con muy buena evolución clínica. Finalmente fue otorgada el alta domiciliaria”.
El uso de la fagoterapia no está aún regulado por ley en Uruguay y queda a criterio del médico con consentimiento informado del paciente.
“En la actualidad el MSP está evaluando dos líneas de tratamientos planteadas por Kinzbio. La de superficies en ámbitos sanitarios (productos con fagos para desinfección de hospitales) y los tratamientos personalizados”, le cuenta a BBC Mundo el doctor Gustavo Gaye, asesor del Subsecretario y Ministra del Ministerio de Salud Pública (MSP) de Uruguay.
“Tanto unos como otros están en trámites de evaluación a los efectos de dar todas las garantías necesarias a todas las partes involucradas”.
Pandemia silenciosa
El caso relatado por Grill ilustra la necesidad de dar respuesta a lo que tanto la Organización Mundial de la Salud (OMS) como la Organización Panamericana de la Salud (OPS) consideran uno de los mayores problemas de salud global en la actualidad.
“La resistencia a los antimicrobianos ha sido definida como una pandemia silenciosa”, le dice a BBC Mundo la doctora Pilar Ramón-Pardo, jefa del Programa Especial sobre Resistencia a los Antimicrobianos de la Organización Panamericana de la Salud, OPS.

Fuente de la imagen, Getty Images
“No solo ya está provocando un exceso de millones de muertes de personas, mayor sufrimiento y un aumento de los costes de atención de salud, sino también la pérdida de vidas de animales, que tendrá graves efectos en los medios de subsistencia y la seguridad alimentaria”.
La OMS estima que las infecciones con bacterias resistentes fueron directamente responsables en 2019 de 1,27 millones de muertes en todo el mundo y contribuyeron a 4,95 millones de muertes.
“En América Latina y el Caribe uno de los mayores problemas consiste en el desconocimiento de la dimensión del problema. Muchas personas no saben que ellas o su ganado pueden tener una infección resistente y a menudo quienes les suministran tratamiento tampoco lo saben”.
La resistencia a los antimicrobianos ocurre naturalmente con el tiempo a través de cambios genéticos.
Pero uno de los factores detrás de su aumento es el “uso excesivo y abusivo de los antibióticos en la medicina humana, en veterinaria y en la agricultura”, explica la Ramón-Pardo.
“Un ejemplo en el sector sanitario sería la administración de antibióticos cuando no es necesario o no elegir el medicamento adecuado para cada circunstancia, como podría ser utilizar antibióticos de amplio espectro cuando no está indicado, o no administrarlos en la dosis y duración adecuada”.
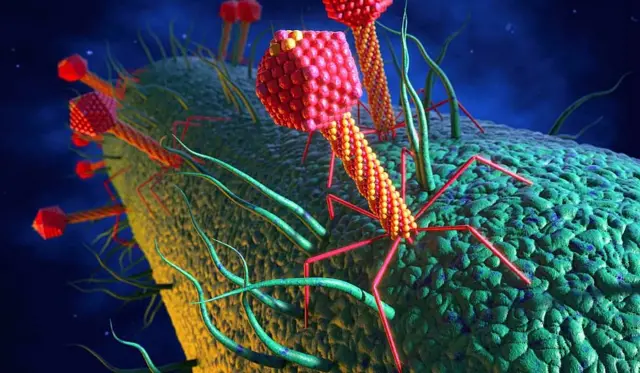
Fagos: los virus que comen bacterias
El término bacteriófago deriva del griego y significa literalmente “que come bacterias”.
Los fagos son las entidades biológicas más abundantes de la Tierra, le explica Iraola a BBC Mundo.
“Son virus que tienen la capacidad únicamente de infectar y eliminar bacterias”.
“Las bacterias en el planeta están por todos lados y en todos los ambientes donde haya bacterias va a haber también bacteriófagos”.
“Nosotros recuperamos bacteriófagos de agua residual, de efluentes hospitalarios, de materia fecal de animales, de agua de río, de cualquier lugar que vos te imagines donde puede haber una concentración alta de bacterias ahí naturalmente va a haber bacteriófagos”.
Fuente de la imagen, Science Photo Library
Los fagos fueron descubiertos hace cerca de un siglo y comenzaron a ser utilizados como herramientas terapéuticas incluso antes de que se descubriera el primer antibiótico, la penicilina.
“Pero los antibióticos, que eran mucho más fáciles de producir, se masificaron y los bacteriófagos quedaron de lado”.
Sin embargo, el creciente problema de la resistencia a los antibióticos y la necesidad de hallar alternativas revivió en las últimas dos décadas el interés en los bacteriófagos.
La bióloga Josefina Puig, cofundadora de Kinzbio, explica que “la mayor ventaja que presentan los bacteriófagos frente a los antibióticos es que al no tener efectos secundarios a largo plazo se pueden diseñar tratamientos prolongados y mayores dosis sin generar toxicidad para el organismo”.
Por otro lado, agrega Iraola, “son bastante específicos. Cuando uno utiliza un bacteriófago como herramienta terapéutica, éste va a estar dirigido específicamente a la bacteria problema y no va a afectar, por ejemplo, el microbioma de la persona. Son literalmente verdugos de bacterias.”
La “biblioteca” de virus
La idea de crear Kinzbio nació en 2020, cuando Iraola y Puig trabajaban como investigadores en temas relacionados con covid.
“Justamente en plena pandemia causada por un virus malo a nosotros se nos ocurre hacer una empresa con virus buenos”, recuerda Iraola.
La empresa se constituyó en 2021. Un año después fue declarada de interés ministerial por el Ministerio de Salud Pública de Uruguay y en 2023 fue galardonada con el premio Nova de la Agencia Nacional de Investigación e Innovación (ANII).
Los inversores iniciales de la startup fueron empresarios locales que tenían un interés especial: habían tenido casos de familiares con complicaciones por bacterias multirresistentes.

Fuente de la imagen, © Agustina Galain
Según Iraola, “en Kinzbio hemos desarrollado métodos de laboratorio que nos permiten recuperar de la naturaleza bacteriófagos que no pueden ser encontrados comúnmente, como los llamados ‘bacteriófagos jumbo‘ (fagos con genoma más grande de lo habitual), los cuales tienen ventajas a la hora de aplicarlos como herramientas antimicrobianas respecto a los bacteriófagos tradicionales”.
“Eso nos permite diferenciarnos de otros laboratorios y tener un biobanco de bacteriófagos que es único en el mundo”.
“Por otro lado, hemos creado un conjunto de protocolos que es parte de nuestra propiedad intelectual que nos permite rápidamente generar fármacos personalizados a partir de ese biobanco de bacteriófagos”.
Las bacterias pueden eventualmente desarrollar resistencia contra los fagos.
Sin embargo, Iraola señala que existe tal variedad de bacteriófagos en la naturaleza que será posible encontrar rápidamente otro fago que sea efectivo.
“Velocidad”
Puig explica que todo el proceso de producción, desde que la empresa recibe una muestra de la cepa o bacteria que infecta a un paciente hasta que el medicamento está listo, lleva “entre 5 y 10 días hábiles, dependiendo de la complejidad del caso y la bacteria a tratar”.
El costo del tratamiento, agrega Iraola, es de alrededor de US$20.000. “Un tratamiento estándar en otros países como Estados Unidos o Australia supera los US$50.000”.
Kinzbio ofreció los primeros medicamentos en forma honoraria para demostrar la utilidad de la tecnología, pero el costo de los tratamientos es ahora enfrentado por las familias porque no son cubiertos por los seguros de salud.
“Nuestro objetivo a largo plazo es que no sean los usuarios los que tengan que pagar, sino los prestadores o los sistemas de salud”.
La empresa se especializa en combatir bacterias consideradas de alta prioridad por la OMS por ser de mayor importancia en la resistencia a antibióticos, como las que causan infecciones respiratorias en pacientes con fibrosis quística.
Otro foco son las infecciones en pacientes con prótesis de rodilla o cadera, y las infecciones urinarias.

Fuente de la imagen, © Agustina Galain
Uruguay, “polo regional”
El Ministerio de Salud Pública “ve un excelente potencial” en la terapia con bacteriófagos para combatir la problemática de la resistencia antimicrobiana en Uruguay y en la región, dice el doctor Gaye a BBC Mundo.
“Uruguay hace una apuesta en ciencia y tecnología y en biotecnología para ser referencia o polo regional para combatir esta pandemia con el desarrollo de bacteriófagos”.
La resistencia antimicrobiana tiene un alto costo económico.
Las 1.000 camas de CTI (cuidados intensivos) y CI (cuidados intermedios) que tiene Uruguay están ocupadas en promedio 200 días al año, señala Gaye.
De esos 200 días 115 días en promedio anual son por infecciones resistentes, según datos del informe de vigilancia de resistencia antibiótica del MSP en 2023.
“Si costeamos una cama de CTI a US$ 1.500 al día hablamos de un costo anual de más de US$150 millones de las infecciones por gérmenes resistentes a los antibióticos”.
Para el doctor Fabio Grill, la terapia de fagos “abrió una oportunidad muy interesante en múltiples situaciones donde los antibióticos ya no tienen cabida por la resistencia a los mismos o porque, como en nuestro país, no existen los nuevos antibióticos que ofrecen alternativas terapéuticas”.
“A nuestro entender, los fagos deben ser parte de una terapia antibiótica y por tanto, una alternativa coadyuvante. No es una por otra. Es decir, en determinados modelos infecciosos pueden constituirse como una excelente oportunidad terapéutica, pero siempre sabiendo que el tratamiento con antibióticos sigue siendo la piedra angular”.

Fuente de la imagen, © Agustina Galain
La empresa recibe en promedio una solicitud por semana. Pero fue aquel primer tratamiento tras la llamada del doctor Grill el que más impacto ha tenido en los científicos de Kinzbio.
Iraola describe el tratamiento de aquel primer paciente como el “mayor logro” en lo que va de su carrera.
“El hecho de haber logrado este hito de salvarle la vida a una persona con una tecnología que desarrollamos nosotros fue sin duda para todo el mundo el momento de mayor felicidad desde que se fundó la empresa”, señala el científico a BBC Mundo.
Para Josefina Puig, “fue un momento determinante”.
“Poder aplicar esta tecnología para tratar pacientes era un sueño para mí y todavía no puedo creer que se haya hecho realidad. Me siento muy afortunada y feliz de poder trabajar en esto todos los días”.
“Sentí que todo el trabajo que habíamos realizado durante los últimos tres años había valido la pena”.

Y recuerda que puedes recibir notificaciones en nuestra app. Descarga la última versión y actívalas.
Cortesía de BBC Noticias
Dejanos un comentario:
