Hay momentos en que el cuerpo necesita reaccionar de forma inmediata: tras una comida rica en azúcar, por ejemplo, las células del hígado se ponen a trabajar para almacenar la glucosa sobrante. Lo que ocurre en esos minutos decisivos ha sido, hasta ahora, un territorio poco explorado. ¿Dónde va exactamente esa glucosa? ¿Qué caminos recorre dentro de las células? ¿Qué estructuras se activan para procesarla y almacenarla?
Un equipo internacional de científicos, liderado desde la Universidad de Vanderbilt, ha logrado trazar con altísima precisión el destino de las moléculas de glucosa en el cuerpo vivo, desde que entran en el sistema hasta que se almacenan o transforman dentro de los orgánulos celulares. Gracias a una combinación inédita de microscopía electrónica, inteligencia artificial y técnicas de etiquetado isotópico, el estudio revela una arquitectura energética interna más compleja y organizada de lo que se pensaba. Según sus autores, “revela el patrón espacial del flujo de glucosa 13C en hepatocitos in situ” y permite ver, por primera vez, los contactos dinámicos entre mitocondrias, gotitas de grasa y el retículo endoplasmático.
Hasta ahora, la mayor parte de lo que se sabía sobre cómo las células usan nutrientes como la glucosa procedía de análisis de conjunto. Es decir, se observaban tejidos enteros, sin distinguir lo que sucedía en cada célula concreta o en las distintas partes de esa célula. Eso era como estudiar el tráfico de una ciudad solo con una imagen satelital, sin saber qué ocurre en cada cruce.
Este estudio da un salto radical. Los investigadores aplicaron una combinación de tecnologías que incluye etiquetado con isótopos de carbono, microscopía de masas y análisis con inteligencia artificial, para observar cómo se mueve y transforma la glucosa en animales vivos. En palabras del artículo científico, se trata de un enfoque para “cuantificar el flujo de glucosa y determinar el destino de los elementos derivados de la glucosa… desde animales completos hasta compartimentos subcelulares”.
Lo más impresionante es que no solo vieron qué metabolitos se generaban, sino dónde exactamente lo hacían. Y eso llevó a detectar estructuras inesperadas: redes organizadas de orgánulos que colaboran para responder al exceso de glucosa.
El papel oculto de las gotitas de grasa
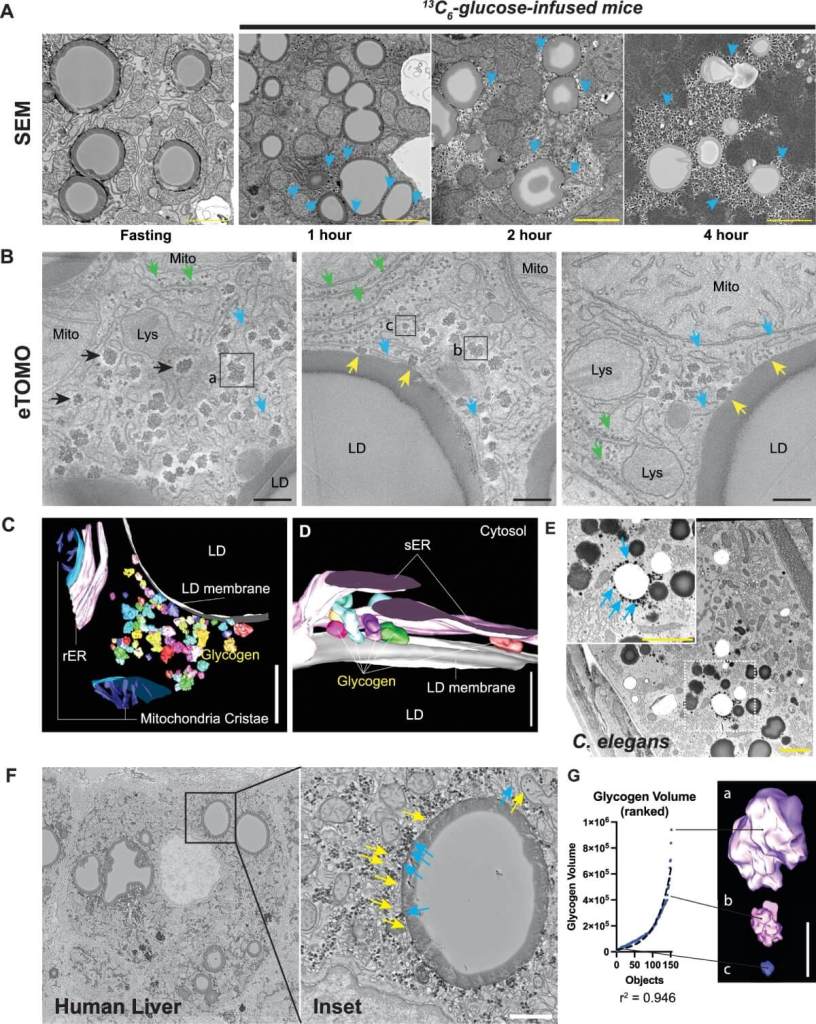
Uno de los hallazgos más llamativos fue la asociación física entre las gotas de grasa intracelulares (lipid droplets) y los cúmulos de glucógeno, la forma en que el cuerpo almacena glucosa. Gracias a las imágenes obtenidas con tomografía electrónica 3D, los científicos observaron que las moléculas recién sintetizadas de glucógeno aparecen rodeando directamente a estas gotas, en contacto estrecho con el retículo endoplasmático.
Este detalle no es menor. Significa que las gotas de grasa no solo almacenan lípidos, sino que también podrían actuar como una especie de plataforma para iniciar la síntesis de glucógeno. En palabras del artículo, “la síntesis de glucógeno ocurre sobre y alrededor del andamiaje formado por las gotas lipídicas de los hepatocitos”.
Este hallazgo cambia la forma de entender cómo el hígado regula el almacenamiento de energía. Lo que antes se veía como compartimentos independientes —uno para las grasas y otro para los azúcares— ahora aparece como una estructura integrada y altamente organizada.
Mitocondrias y retículo endoplasmático: una conexión que se rompe y se rehace
Otro elemento crucial que emerge del estudio es la observación de cómo cambian los contactos entre las mitocondrias y el retículo endoplasmático cuando varía la cantidad de glucosa en sangre. Estas conexiones son fundamentales porque permiten el intercambio de señales y metabolitos entre los dos orgánulos, algo vital para mantener la estabilidad energética de la célula.
Los autores muestran que en condiciones de ayuno, estos contactos son más numerosos y estables, mientras que cuando la glucosa entra en la célula, los puntos de contacto disminuyen rápidamente. Es decir, la célula reorganiza sus redes internas en función de la disponibilidad de energía.
Esto no solo tiene relevancia fisiológica, sino que podría ayudar a entender por qué ciertos fallos en estas conexiones están implicados en enfermedades como la diabetes o trastornos neurodegenerativos. Como se señala en el estudio, “los contactos mitocondria-retículo endoplasmático se reorganizan desde un modelo centrado en el ER hacia uno centrado en el glucógeno durante la glucogénesis”.
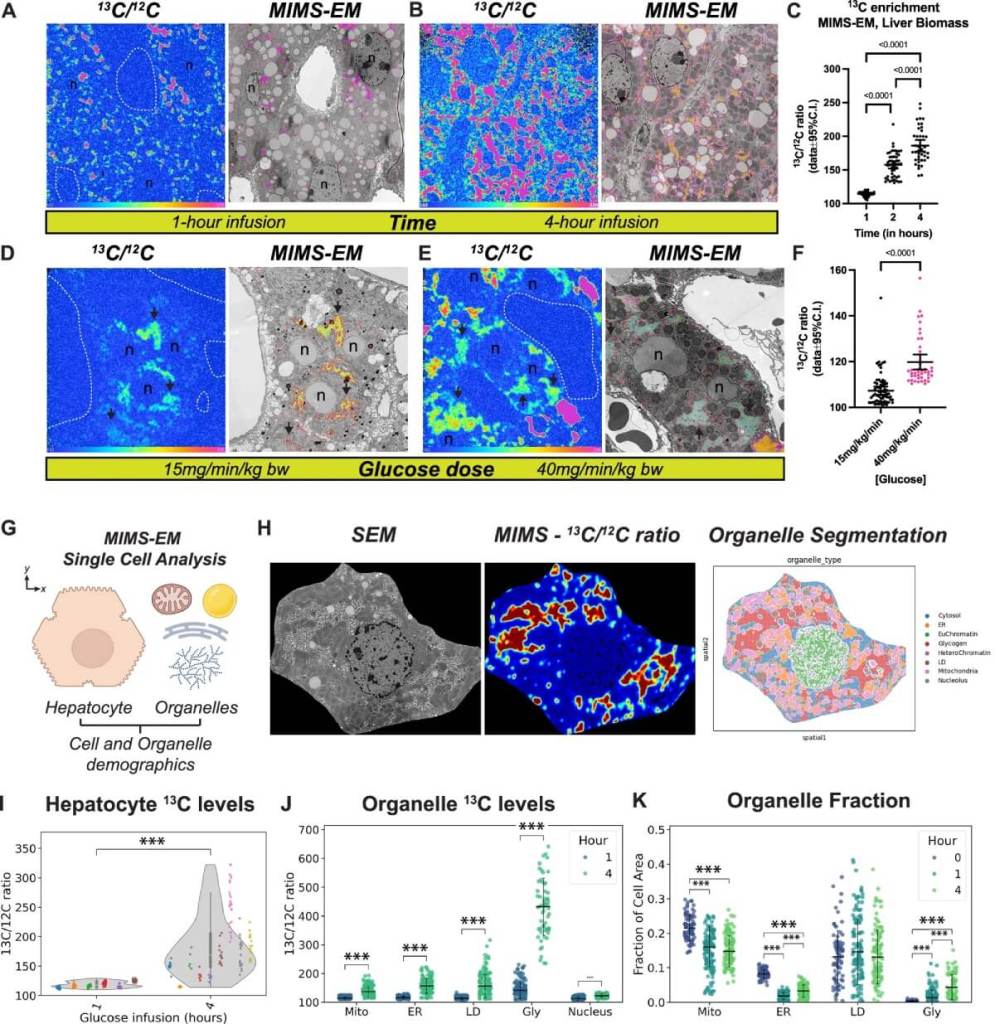
La herramienta principal que permitió estas observaciones se llama MIMS-EM (Microscopía de masas por imagen con microscopía electrónica correlativa). Esta técnica permite medir la cantidad de átomos de carbono-13, un isótopo estable que no altera la biología natural, en estructuras tan pequeñas como mitocondrias o depósitos de glucógeno.
Al aplicar glucosa marcada con carbono-13 a ratones vivos y observar cómo se incorporaba en los tejidos, los científicos pudieron reconstruir un mapa tridimensional que muestra qué orgánulos están activos en la absorción y transformación de glucosa, y cómo esta actividad cambia con el tiempo y el estado metabólico.
Además, combinaron este enfoque con algoritmos de segmentación entrenados con inteligencia artificial, que identificaron y clasificaron miles de orgánulos celulares en función de su morfología y contenido isotópico. Esta escala de resolución no tiene precedentes y abre la puerta a estudiar otras rutas metabólicas con el mismo nivel de detalle.
Qué implicaciones tiene para la salud humana
Más allá del avance tecnológico, los resultados del estudio aportan una base visual y cuantitativa para entender cómo se organiza el metabolismo en condiciones normales y en enfermedades. Por ejemplo, saber exactamente dónde y cuándo se forma el glucógeno podría ayudar a diseñar tratamientos más precisos para personas con diabetes tipo 2, en quienes este proceso está alterado.
También se abre un campo de estudio para trastornos del almacenamiento energético, como ciertas enfermedades hepáticas o musculares. Al entender cómo se agrupan los orgánulos y qué señales provocan su reorganización, será posible intervenir en puntos clave del proceso metabólico sin necesidad de alterar toda la fisiología del cuerpo.
Por ahora, como reconoce el artículo, la técnica es costosa y compleja, y no está disponible en todos los laboratorios. Pero marca un camino. Según los autores, este enfoque “establece un marco multimodal para estudiar las múltiples escalas del metabolismo y el paisaje espacial de las células y el flujo de nutrientes in situ”.
Lo que aún queda por explorar
Aunque este trabajo se centra en el hígado de ratones, los investigadores ya han encontrado estructuras similares en células humanas y en otros organismos, como el nematodo C. elegans. Eso sugiere que este tipo de organización celular es común y está altamente conservada en la evolución.
El siguiente paso será investigar cómo cambian estas redes celulares en distintas condiciones fisiológicas o patológicas, y si se pueden manipular para restaurar un metabolismo sano. La posibilidad de ver en tiempo real cómo fluye la energía dentro de las células es una herramienta poderosa, y este estudio muestra que ya no es solo una promesa: es una realidad científica.
Referencias
- Aliyah Habashy, Christopher Acree, Keun-Young Kim, Ali Zahraei, Martin Dufresne, Sebastien Phan, Melanie Cutler, Emilee Patterson, Alexandra G. Mulligan, Kristopher Burkewitz, Charles Robert Flynn, Louise Lantier, Thomas Deerinck, Owen P. McGuinness, Jeffrey M. Spraggins, Mark H. Ellisman y Rafael Arrojo e Drigo (2025). Spatial patterns of hepatocyte glucose flux revealed by stable isotope tracing and multi-scale microscopy. Nature Communications, 16:5850. https://doi.org/10.1038/s41467-025-60994-w.
Cortesía de Muy Interesante
Dejanos un comentario: